第二季度值得关注的10大生物医药里程碑

重磅减肥疗法多项3期临床试验结果即将出炉
肠促胰岛素疗法在治疗肥胖症患者的临床试验中已经取得出色的效果。比如,诺和诺德的胰高血糖素样肽-1(GLP-1)受体激动剂司美格鲁肽,和礼来公司的GLP-1/葡萄糖依赖性促胰岛素多肽(GIP)受体双重激动剂tirzepatide。第二季度这两款潜在重磅疗法的更多临床试验结果即将出炉。司美格鲁肽用于治疗肥胖症患者的3期临床试验SELECT将评估注射型司美格鲁肽能否降低肥胖症患者的心血管疾病风险(包括中风、心血管死亡,和非致命心脏病发作)。
礼来公司的GLP-1/GIP受体双重激动剂tirzepatide的3项临床试验即将报告减肥结果。Surmount-2的患者群体为2型糖尿病患者,Surmount-3的患者群体为肥胖症患者,Surmount-4检测tirzepatide维持肥胖患者体重减轻的效果。这些数据将帮助完成tirzepatide治疗肥胖症上市申请的滚动递交。
治疗阿尔茨海默症的新希望
礼来公司治疗阿尔茨海默病的抗体疗法donanemab的验证性3期临床试验Trailblazer-Alz 2有望获得结果。在2b期临床试验中,donanemab已经表现出迅速降低患者大脑淀粉样蛋白沉积水平的能力,并且延缓了评估患者认知和生活自理水平的综合指数的衰退。这项3期临床试验将在更为广泛的早期阿尔茨海默病患者中检验donanemab对患者认知和生活自理水平的改善。这一试验结果有望支持donanemab寻求FDA完全批准的上市申请。
此外,RNAi领域明星公司Alnylam Pharmaceuticals和再生元公司联合开发的RNAi疗法ALN-APP利用Alnylam的中枢神经系统递送技术,靶向编码淀粉样蛋白前体(APP)的mRNA。它的目标是通过降解编码APP的mRNA,减少淀粉样蛋白的产生。ALN-APP的首个临床试验结果有望在第二季度公布,如果试验结果积极,它不但验证了Alnylam公司向中枢神经系统递送RNAi疗法的技术平台的有效性,也为阿尔茨海默病带来一种全新的治疗模式。
肿瘤学领域值得关注的临床试验
今年早些时候,默沙东和Moderna公司联合宣布,将重磅PD-1抑制剂Keytruda与Moderna公司开发的个体化新抗原疫苗联用,与Keytruda单药治疗相比,在2b期临床试验中将III、IV期黑色素瘤患者的复发或死亡风险降低44%。这项临床试验的详细结果将在本月召开的美国癌症研究协会(AACR)年会上发布。
第一三共和阿斯利康联合开发的靶向Trop2的抗体偶联药物(ADC)datopotamab deruxtecan用于治疗难治性非小细胞肺癌(NSCLC)的3期临床试验即将公布结果。第一三共和阿斯利康联合开发的靶向HER2的重磅疗法Enhertu在改变HER2阳性癌症治疗方面已经斩获颇丰。Datopotamab deruxtecan使用与Enhertu相同的抗体偶联技术平台,在早期临床试验中,已经在治疗三阴性乳腺癌和非小细胞肺癌方面表现出可喜的抗癌活性。这一试验结果有望支持datopotamab deruxtecan的上市申请递交,并且为Trop2靶向疗法的抗癌潜力提供进一步支持。
非酒精性脂肪性肝炎等待已久的突破要来了吗?
非酒精性脂肪性肝炎(NASH)影响全球超过一亿人,它已经成为导致肝脏移植最主要的原因,然而针对NASH仍然没有一款FDA批准的疗法。这一现状有望在今年得到改变。今年5月19日,FDA将召开咨询委员会会议,讨论Intercept Pharmaceuticals公司的奥贝胆酸用于治疗NASH的新药申请(NDA)。这款在研疗法目前正在接受FDA的审评,预计在今年6月22日之前获得审评结果。这一会议的结果将对首款FDA批准的NASH疗法能否问世产生重要影响。
奥贝胆酸之外,NASH治疗领域近年来多项临床试验获得积极结果。第二季度Viking Therapeutics公司将报告其甲状腺激素受体(THR)-β激动剂VK2735用于治疗NASH患者的临床试验结果。Madrigal Pharmaceuticals公司开发的同样靶向THR-β的口服选择性激动剂resmetirom已经在3期临床试验中获得积极结果。
通过加速批准促进基因疗法上市迎来考验
近日,Sarepta Therapeutics公司宣布,FDA将召集咨询委员会会议,讨论该公司与罗氏(Roche)联合开发的基因疗法SRP 9001的生物制品许可申请(BLA)。这一申请基于SRP 9001提高杜氏肌营养不良(DMD)患者肌肉中抗肌萎缩蛋白表达水平的数据,寻求FDA的加速批准,治疗DMD患者。Sarepta公司表示,在与FDA的交流中,FDA表示出对使用替代终点、生物标志物和加速批准促进先进细胞和基因疗法批准的兴趣,尤其是针对危及生命的罕见退行性疾病。FDA生物制品评价和研究中心主任Peter Marks博士日前也指出,加速批准是把基因疗法更快带给患者的重要手段之一。这一会议的结果不但涉及到首款治疗DMD的基因疗法能否顺利上市,也将对加速批准能否用于促进基因疗法的批准提供洞见。
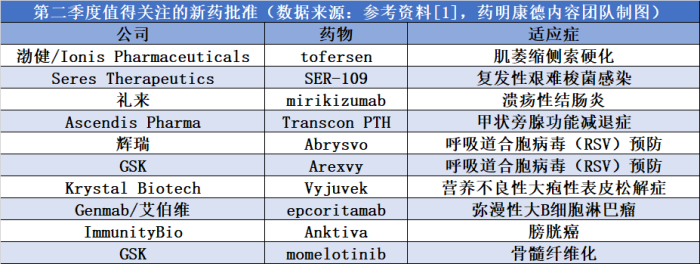
此外,在第二季度,多款创新疗法有望获得FDA的批准,具体信息请见下表:
药明康德内容团队编辑
内容来源:药明康德
责任编辑:胡静 审核人:何发
邵丽竹
何发
热点文章
-
一文看懂新药研发到上市的全流程
2025-11-25
-
《药包材GMP(2025)》与药品GMP深度对比:核心差异、新增要点与实施指引
2025-11-25
-
浅谈非最终灭菌产品制剂车间无菌工艺模拟试验中的要点与设计
2025-11-18
-
人工智能在生物医药领域的应用前景分析及对策建议
2025-11-14
-
制药生产标准不断提升:原料药与高活性原料药的密闭隔离解决方案
2025-11-19
-
一文掌握一条产业链:医药板块
2025-11-17
-
从"制造"到"智造",默克如何进行数字化转型?
2025-11-21
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多