基石药业的舒格利单抗领跑PD-L1江湖,深究突破内卷的密码
从攻占肺癌大适应症,到围猎辅助/新辅助治疗,K药版图逐日拓宽,销售额继续增加是必然事件。
K药的成功,不仅为众多PD-1抑制剂指明了方向,也给PD-L1抑制剂留下了突围路径。
作为PD-1的配体,PD-L1同样是对抗肿瘤的一个重要靶点。不过,相比PD-1,全球PD-L1的适应症开发相对滞后。如何从PD-L1抑制剂领域突围,还有待强者给出答案。
始终保持锐意,持续突破的案例中,基石药业是一个难得的样本。在全球PD-L1抑制剂研发领域,基石药业的舒格利单抗处于领跑位置。
1月3日,基石药业宣布舒格利单抗(择捷美®)的GEMSTONE-304临床成功。
这意味着,舒格利单抗成为全球首个,针对无法手术切除的局部晚期、复发或转移性食管鳞癌,取得阳性结果的PD-L1单抗。包括度伐利尤单抗、阿替利珠单抗在内的海外PD-L1单抗,均未能取得类似成果。
实际上,在此之前,舒格利单抗已拿下多个高发癌种领域“全球首个”的桂冠。此次GEMSTONE-304临床成功,对于基石药业更大的意义在于,舒格利单抗成功解锁了“高发肿瘤治疗大满贯”成就。
喝彩与期待的同时,市场或许会追问:为什么是基石药业?
/ 01 /率先拿下“大满贯”
作为广谱抗癌药物,PD-(L)1抑制剂的天花板的高低,取决于适应症的多寡。也正因此,全球头部药企,均在不断突围。
在PD-L1领域,基石药业称得上是“标杆”,其已在众多“无人区”率先突围。比如,上文提到的食管鳞癌适应症。
一直以来,食管鳞癌患者都在期待更有效的新疗法上市,因为传统化疗等治疗手段的生存获益情况有限。
当前,一线化疗的客观缓解率仅为30%至42.9%;中位总生存期为6.7-17.0个月,即便有效的患者生存期也不到两年。
如今,K药已论证了免疫疗法作为食管鳞癌治疗手段的可行性,舒格利单抗则有望给该适应症患者带来更多治疗选择。
在GEMSTONE-304临床试验中,舒格利单抗展现出不错的治疗效果与安全性。
可以看到,舒格利单抗的加入,显著改善了患者的无进展生存期和总生存期。虽然具体数据有待披露,但根据基石药业早期公布的替代终点数据来看,结果值得期待。
2020年ESMO会议上,基石药业公布的Ib期研究显示,该联合治疗方案作为一线治疗晚期食管鳞癌的客观缓解率达67.6%,疾病控制率达89.2%,且缓解可持续,效果远远超过一线化疗数据。
与此同时,该联合疗法展现出良好的安全性。基石药业表示,安全性与既往报道的舒格利单抗相关临床研究结果一致,未发现新的安全性信号。
目前,全球尚无一款PD-L1抗体获批用于治疗食管癌,兼顾治疗效果与安全性特点的舒格利单抗,无疑能够给更多患者送去福音。
基石药业则表示,计划近期递交舒格利单抗该项新适应症的上市申请。若顺利推进,舒格利单抗有望成为全球首个,在食管鳞癌一线疗法获批的PD-L1单抗。
实际上,率先“撞线”对于舒格利单抗来说已是常规操作。在此之前,舒格利单抗已在多个高发癌种领域,成功解锁“全球首个”的成就。
比如,在大适应症肺癌领域,舒格利单抗不仅是全球首个联合化疗获批一线治疗IV期转移性鳞状和非鳞状非小细胞癌患者的PD-L1抗体;也是全球首个获批用于治疗同步或序贯放化疗III期非小细胞癌患者的PD-(L)1抗体。
2022年11月,舒格利单抗GEMSTONE-303临床研究达到主要终点。这意味着,在胃/胃食管结合部腺癌适应症领域,舒格利单抗成为全球首个在III期研究中取得阳性结果的PD-L1单抗,且OS显示出明显获益趋势。
如今,随着食管鳞癌三期临床成功,舒格利单抗已解锁多个高发癌肿领域的第一,拿下高发肿瘤治疗“大满贯”,领先于海外药企。
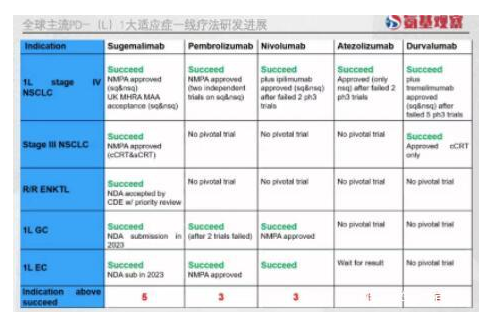
如上图所示,舒格利单抗在非小细胞肺癌、胃癌、食管癌等大适应症一线疗法的研发进度,不仅领先于阿替利珠单抗、度伐利尤单抗等PD-L1抑制剂,也胜过K药、O药等PD-1抑制剂。
择捷美®是由基石药业开发的抗PD-L1单克隆抗体,择捷美®的开发是基于美国Ligand公司授权引进的OmniRat®转基因动物平台。被称为“潜在最优药物”。
/ 02 /择捷美®杰出的临床表现
择捷美®不仅在诸多适应症领域全面开花,而且其带来的临床获益也不容小觑,要么比肩世界药王,要么实现了零的突破。
择捷美®在IV期NSCLC领域的临床数据是与默沙东的K药展开竞争,因为K药是此领域全球医生公认的首选肿瘤免疫治疗(IO)药物。此处以HR of PFS值衡量药效,该值越低越好。K药在KEYNOTE-407研究中用于治疗IV期NSCLC鳞癌患者,HR OF PFS为0.59;在CheckMate 9LA中用于治疗鳞癌和非鳞癌患者,HR OF PFS为0.70;在KEYNOTE-189中用于治疗非鳞癌患者,HR OF PFS为0.49。择捷美®在GEMSTONE-302中用于治疗IV期NSCLC鳞癌和非鳞癌患者,鳞癌患者的HR OF PFS仅为0.34,非鳞癌患者的HR OF PFS是0.59,全部患者的HR OF PFS为0.48。两相比较,择捷美®毫不逊色,并且GEMSTONE-302研究已经达到OS的研究终点,OS数据证明择捷美®完全可以成为晚期NSCLC的首选IO药物。
择捷美®在III期NSCLC领域的临床数据可与阿斯利康的I药一较高下,后者是该领域的金标准疗法。择捷美®与I药的18个月无进展生存(PFS)率非常接近(43.5%:44.2%),而择捷美®比I药更早获得包括经同步放化疗和经序贯放化疗在内的两类患者的研究数据,是全球首个显著改善同步或序贯放化疗后无疾病进展的III期NSCLC患者PFS的PD-(L)1单抗。
择捷美®在R/R ENKTL领域的表现超越了其他PD-(L)1抗体。该领域目前无可对标品种,但美国和中国药监部门均给予择捷美®突破性疗法认定。相较于历史对照,舒格利单抗显著提高了客观缓解率(ORR),独立影像评估委员会评估的ORR为46.2%;完全缓解(CR)率达到37.2%,高于目前已知数据,在很大程度上预示着舒格利单抗在改善ORR的同时,极有可能也为R/RENKTL带来生存获益。
择捷美®在晚期GC/GEJ和ESCC两个领域,都取得了I药和T药未能取得的阳性结果。用于GC/GEJ患者时,与安慰剂联合化疗对照组相比,择捷美®联合化疗显著改善研究者评估的PFS,风险比0.66,差异具有统计学显著性与临床意义,OS显示出明显的获益趋势,风险比0.75。用于ESCC患者时,与安慰剂联合化疗相比,择捷美®联合化疗明显改善盲态独立中心审阅委员会(BICR)评估的PFS和OS,差异具有统计学显著性与临床意义。
这些杰出的临床表现很大程度上都归功于择捷美®特殊设计。它是来自Ligand公司OmniRat平台的全人源、全长的IgG4单克隆抗体,能最大程度地减少抗药物抗体;它是唯一天然缺失ADCC/CDC活性的PD-L1抗体,具有更好的安全性,并可避免不必要的T细胞受损;它独特地保留ADCP活性,可引起巨噬细胞直接吞灭肿瘤细胞,同时加强肿瘤细胞抗原表达,能带来长期抗肿瘤免疫。
2022年1月,择捷美®GEMSTONE-301和GEMSTONE-302两项研究结果在《柳叶刀·肿瘤学》特邀同期发表,彰显了全球权威学术期刊、国际学术界对择捷美®创新而合理的研究设计、优质的研究质量以及突出的研究结果的认可。
目前,择捷美®正处于从临床走向市场的过程中,基石药业正携手辉瑞数千人规模的肿瘤团队共同开发中国大陆市场,基于广泛的适用性和极为突出的疗效优势,势必会给中国的医生和患者带来更好的治疗体验。
此外,基石药业与合作伙伴EQRx公司制订的以英国为首站出海欧洲的策略也已迈出了稳健的第一步。2022年12月,舒格利单抗用于治疗转移性NSCLC的上市许可申请获英国药品和医疗保健用品管理局受理,这是其在中国境外的首个上市许可申请,标志着其正式开启出海旅程,也预示着其已经非常接近登陆不亚于美国的年规模过百亿美元的欧洲市场。对于认真做药的基石药业,2023年一定会更好。
/ 03 /基于实力的突围
研发一款新药适应症,实力与策略的正确与否,将最终决定药品商业价值的大小。K药如此,舒格利单抗也不例外。
舒格利单抗能够率先拿下大满贯桂冠,与基石药业的策略与实力密不可分。
尽管从全球范围来看,舒格利单抗是一个跟随者。比如国内,其仅是第12个进入临床阶段的PD-(L)1。
但与大部分跟随者盲从有所不同的是,从研发伊始,基石药业贯彻聚焦高发肿瘤类型、坚持进军大适应症一线治疗战略决策。
正如上文所说,舒格利单抗部分率先解锁的大适应症一线疗法,即便是K药、O药等先驱们,至今尚未触及。
Biotech的本质是探索,向无人区冲锋。从一开始就贯彻这一策略的基石药业,也顺势拿到了“大满贯”。
不过,看到这里,你或许会感到疑惑,舒格利单抗为什么能够另辟蹊径?这背后,离不开基石药业实力的支撑。
具体拆解,“实力”可以分为两个维度:一是舒格利单抗差异化的设计,二是基石药业的临床能力,前者决定着产品的天花板,后者则决定研发进度的快慢,两者共同决定一款创新药的前景。
众所周知,结构可以决定分子功能,从而进一步影响其应用,PD-L1抗体也是如此。
一般而言,抗体在结合靶细胞后,会召唤免疫细胞进行打击,且打击手段众多,分为ADCC效应、ADCP效应、CDC效应。
但PD-L1抗体的核心机制,是通过阻断PD-1 / PD-L1信号通路起到抗肿瘤作用。因此,为了避免不必要的潜在副作用,PD-L1抗体通常会去掉ADCC效应、ADCP效应,罗氏的阿替利珠单抗、阿斯利康的度伐利尤单抗均是如此。
而舒格利单抗分子的独特之处在于,其是唯一天然缺失ADCC/CDC活性,但保留ADCP活性PD-L1抗体。
天然缺失ADCC/CDC活性,能够带来更好的安全性,且可避免不必要的T细胞受损。保留ADCP活性,则能带来“补刀”作用,不仅能够引起巨噬细胞直接吞灭肿瘤细胞,增强杀伤肿瘤细胞的效果;且当ADCP效应启动时,巨噬细胞等会将加工过的肿瘤抗原呈递给T细胞,从而启动长期的肿瘤特异性免疫。
另外,与多数国产PD-(L)1抗体采用杂交瘤人源化筛选的方式不同,舒格利单抗来自Ligand公司OmniRat平台,是一种最接近人体的IgG4单抗药物,因此在患者体内产生免疫原性及相关毒性的风险更低。
差异化的分子,决定了舒格利单抗同类最佳的潜质。与此同时,基石药业突出的临床能力,是舒格利单抗后来居上的又一后盾。
在各项临床研究中,我们都能看到基石药业创新性的设计以及高效的运营。
比如,舒格利单抗针对III期非小细胞肺癌的3期研究,入组的除了同步放化疗患者外,还包括序贯放化疗患者。
这一设计的亮点在于,能够通过覆盖更广的人群,缩短临床周期,加速在无人区的突围。而基石药业高效的运营能力则保证了这一可能。
该临床从2018年10月开始,首例患者入组至申请上市仅用了不到3年时间。从周期来看,甚至快过恒瑞医药在肺癌相近适应症的三期临床周期。
正是得益于此,舒格利单抗成为了全球首个获批用于治疗同步或序贯放化疗III期非小细胞癌患者的PD-(L)1抗体。
(基石药业PD-L1里程碑节点)
可以说,任何时候,“唯快不破”都是创新药脱颖而出的利器之一。核心在于,新药开发的最大挑战之一是周期长,而整个研发周期中时间最长、最复杂的正是临床试验阶段,稍有不慎都有可能被超车,让产品的商业价值大打折扣甚至清零。只有足够强的临床能力,才能将风险降到最低。
从这个角度来说,临床开发能力也是产品差异化的重要一环,直接影响着产品的竞争力和前景。
正是得益于“基石速度”,使得舒格利单抗在全球PD-L1抑制剂的争夺战中保持领先身位,解锁“大满贯”,进而打开自身天花板。
/ 04 /突破内卷的答案
在肿瘤治疗领域,向来有得大癌种得天下的说法。
对于基石药业而言,舒格利单抗能够在大癌种领域持续突围,意味着其潜在销售额峰值的水涨船高。
就拿食管癌来说,作为最具侵袭性的恶性肿瘤之一,是全球第七大常见癌症和第六大癌症死亡原因,中国更是占全球食管癌病例的近一半。国家癌症中心统计,2020年我国食管癌患者新发病人数达25.3万人。
在临床中,约70%食管癌患者在疾病初诊时已发展为局部晚期或有远处转移,即使在可手术的食管癌中,50%-60%的患者在术后会复发或发生远处转移。
此次舒格利单抗GEMSTONE-304研究取得成功,无疑表明其能够解决大部分食管癌患者生存获益不高的痛点。
不难预见,舒格利单抗在满足临床未满足需求的同时,也会为基石药业带来可观的商业回报。不仅是食管鳞癌,舒格利单抗此前成功突围的肺癌、胃癌等相关适应症,同样如此。
这在当下内卷的市场环境中,显得尤为重要。
当然,从研发到商业化,创新药都是一场残酷的竞争。biotech要想脱颖而出,不仅要有足够强的研发实力和临床能力,强大的合作伙伴生态也愈发重要。原因在于,合作伙伴生态能够在管线补充、商业化协同等方面,让biotech如虎添翼。
这一点,基石药业依然是参考范例。在国内,基石药业的朋友圈包括辉瑞、恒瑞医药等国内外药企巨头。其中,辉瑞负责舒格利单抗在中国大陆的商业化,恒瑞医药则引进了基石药业另一款明星免疫肿瘤药物CTLA-4单抗。
在海外,基石药业也拥有强大的朋友圈,能使其产品的商业价值最大化。比如,得益于明星公司EQRx,舒格利单抗在国产PD-(L)1的出海征途中占得先机。
2022年12月19日,舒格利单抗联合化疗一线治疗转移性非小细胞肺癌的上市许可申请,获英国药品和医疗保健用品管理局受理。
由于该药物在2021年就在英国获得了创新许可与准入途径ILAP资质,因此有一定概率成为第一个在英国,乃至欧洲获批的国产PD-(L)1单抗。
有数据显示,到2025年,欧洲PD-(L)1抗体销售规模大约157亿美元,其中英国会超过22亿美元。
舒格利单抗各适应症在欧洲上市乃至商业化工作的推进,意味着其可能给基石药业带来数千万美金级别的上市许可里程碑付款,和每年上亿美元销售分成。也正因此,市场对舒格利单抗的欧洲之旅充满期待。
不难想象,安全性更为优秀的舒格利单抗,将为联合治疗提供更多的可能性。未来,舒格利单抗的全球市场空间值得期待。
而在此之前,大部分人认为,PD-(L)1已经是一门缺乏想象空间和盈利能力的苦生意,所有药企都不得不接受沉重又残酷的现实。
但如今,国内外同步打开的局面,舒格利单抗依然可能助力基石药业稳居biopharma第一阵营。
何以突破内卷?唯有实力二字。舒格利单抗的成功,再次证明了这一点。这也将给国内药企,带来更多启示。
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多