PD-1赴美之路“一波三折”,诺华放弃一线鼻咽癌上市申请
诺华为了不错失PD-1巨大的利益市场,今年1月,就百济神州自主研发的PD-1药物替雷利珠单抗在全球多个国家的开发和分销权达成了合作与授权协议。如若达到销售里程碑事件,百济神州还将获得至多2.5亿美元付款,总交易金额超22亿美元。
但全球范围内获批上市的PD-1单抗已经数量不菲,诺华此次加码又能否在已饱和的市场创造奇迹?
10月25日,诺华公布第三季度业绩,同时更新了2022年管线进展,将放弃原计划今年在美国递交替雷利珠单抗(tislelizumab)一线治疗鼻咽癌(NPC)适应症相关申请。
据悉,替雷利珠单抗一线治疗NPC研究为RATIONALE-309。该试验旨在评估替雷利珠单抗联合吉西他滨和顺铂一线治疗复发或转移性NPC患者的有效性和安全性。
根据2022年ASCO最新更新的数据,截至2021年9月31日,IRC评估的PFS与中期分析一致,替雷利珠单抗组相较于安慰剂表现出了显著改善。
● l研究允许对照组在一线治疗进展后,交叉使用替雷利珠单抗治疗,并首次报道了其PFS2数据。与安慰剂联合化疗组相比,替雷利珠单抗联合化疗组的PFS2显著延长,HR值为0.38(0.25, 0.58)。
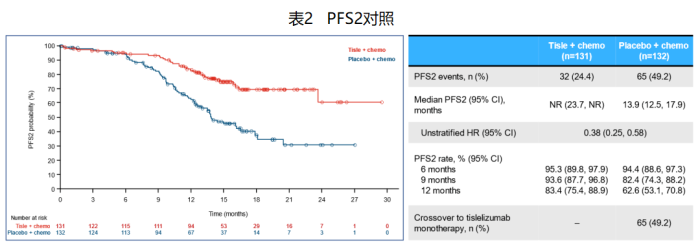
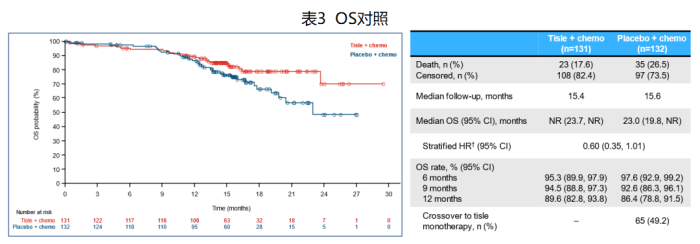
● lOS尚不成熟,与安慰剂联合化疗组相比,替雷利珠单抗联合化疗组OS显示延长趋势,HR值为0.60(0.35, 1.01)。
替雷利珠单抗研究结果提示,在联合疗法的一线使用中,结果明显优于二线使用,但值得注意的是,研究有263例亚洲患者入组试验。类似地,这不免让人联想起,此前,美国三位共和党人还联名向FDA局长Robert Califf发送了一封关于中国临床试验的信函,表明了仅依赖于单一国家患者入组的临床试验可能无法代表美国患者群体的坚定立场。
信迪利单抗作为首款国产PD-1初次登陆美国市场的“试金石”,却也难免吃了闭门羹。该药由于入组单一的临床数据,最终FDA专家委员会以14:1的投票结果,认为信迪利单抗应该扩充临床试验入组患者,将其拒之门外。
无独有偶,也是由于患者入组范围的原因,诺华和百济神州将放弃替雷利珠单抗在美国申请二、三线单药治疗非小细胞肺癌(NSCLC)的适应症相关申请。在诺华的第二季度电话会中,诺华首席执行官Vas Narasimhan强调:“我确实认为FDA现在已经明确表示,他们希望提交的任何研究都是全球性的,后者有适当数量的美国患者,并且使用的护理标准也能反映美国的相关要求。”
自诺华2021年1月斥资6.5亿美元引进替雷利珠单抗以来,海外上市之路就一波三折。在此之前,百济神州还曾发布公告称,由于COVID-19疫情相关限制,FDA无法在中国进行现场检查。FDA无限期推迟了对替雷利珠单抗二线治疗食管癌(ESCC)审批决定。
目前,替雷利珠单抗已在中国获批九项适应症,不过鉴于美国市场的变化和COVID-19造成的影响,替雷利珠单抗何时进入美国市场尚未可知。
从诺华申报计划来看,仍对替雷利珠单抗寄予厚望,根据时间表,诺华将在2023年继续在美申报替雷利珠单抗在不同实体瘤适应症的上市申请,同时扩大该药的开发计划,以进一步研究新颖协同组合的潜力。

除布局美国市场,替雷利珠单抗用于治疗一线、二线NSCLC和二线ESCC的新药上市申请已获澳大利亚药品监督管理局(TGA)与英国药品与保健品管理局(MHRA)受理。
现阶段,诺华与百济神州正于全球和中国开展广泛对替雷利珠单抗关键性临床项目进行评估,在30个国家和地区开展了50项临床试验,包括在中国和全球启动或完成了超过20项潜在的注册可用的临床试验,入组受试者超过1万人。百济神州预计,这些临床试验可用于全球药政审批。
参考资料:
1.Novart is tosses more US PD-1 submission plans and another anti-CD40 drug indication;ENDPOINTS NEWS
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多