小试到中试放大的深入剖析
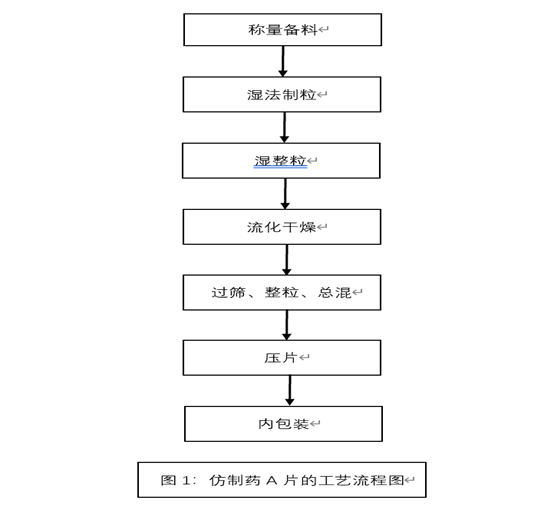
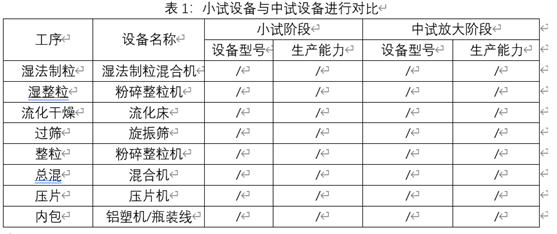
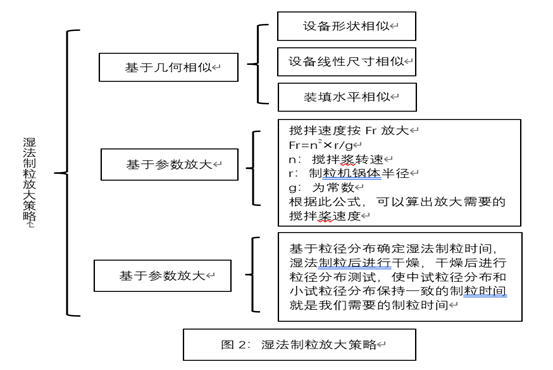
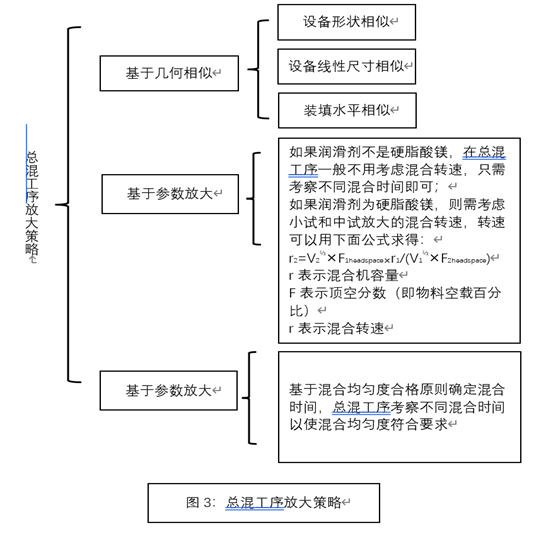
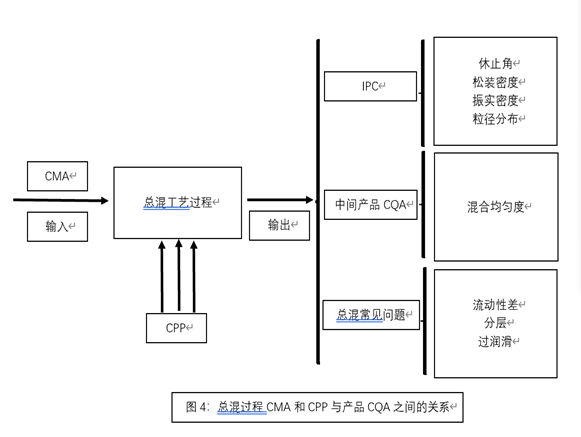
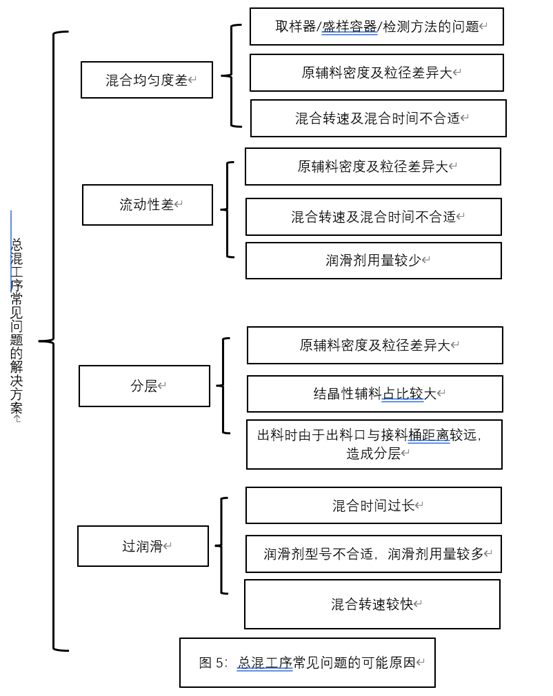
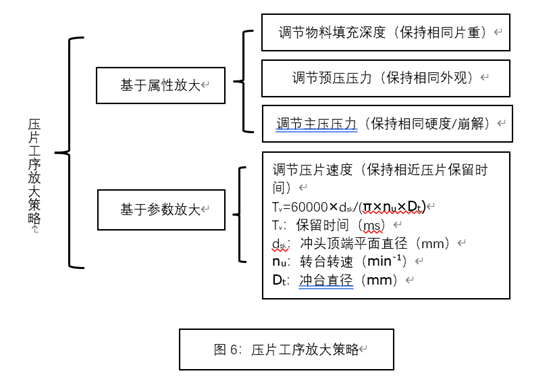
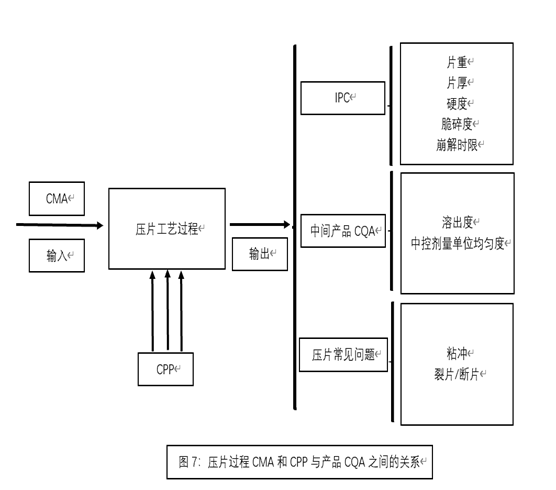
-
a总混物料水分高; -
b粘合剂用量少,物料内聚力不够; -
c润滑剂用量少; -
d物料细粉占比较多; -
e环境相对湿度高;
-
b粘合剂用量太少; -
c细粉太多,调整制粒参数,搅拌桨转速增大、制粒刀转速减少、增加制粒时间,控制细粉比例; -
d处方中塑性辅料太少,增加处方中塑性辅料占比,例如微晶纤维素、可压性淀粉 -
e压片速度太快,保压时间不够长; -
f预压力不够大,粉末中留有大量空气,主压力太大; -
g选择D型冲模具,在压片速度不变的情况下,可以增加保压时间。最常用于压片机的冲模哟B型和D型冲模,B型冲冲顶直径为9.33mm(标准冲顶结构)或9.53mm(半圆形冲顶结构);D型冲冲顶直径为15.53mm(标准冲顶结构)或15.87mm(半圆形冲顶结构);D型冲的冲顶直径远远大于B型冲冲顶直径,所以压片时D型冲保压时间大于B型冲,不易出现断片/裂片问题。
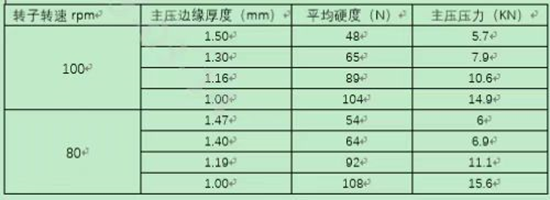
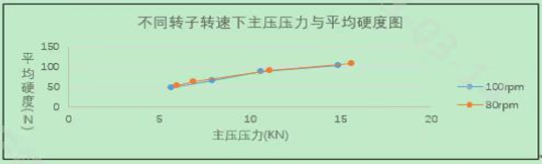
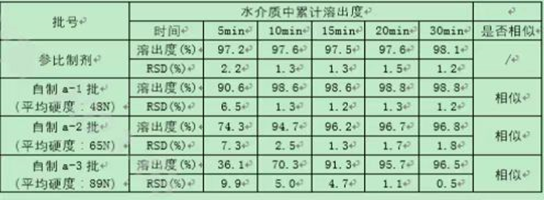
小结:小试到中试放大生产,在充分了解处方工艺开发过程和知识基础上,确定关键物料属性(CMA)和关键工艺参数(CPP)与关键质量属性(CQA)的关系;基于风险评估的原则,在中试放大生产前,考虑可能出现的问题,从而进行风险的规避;在中试放大生产遇到问题时,能迅速找到问题所在,从而解决问题。
内容来源:药事纵横
责任编辑:胡静 审核人:何发
热点文章
-
一文告诉你如何超全面做好清洁验证?
2024-09-04
-
2025版药典有哪些内容变动
2024-09-23
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
实战解析-化学仿制药注射剂过量灌装(注射液)
2024-09-09
-
中国药典2025版带来的冲击和影响
2024-10-04
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
生物制品生产质量风险管理常见问题分析与建议(含16个案例分析)
2024-09-19
-
降本增效的能源管理实施建议
能源是制造业的命脉,成本占比日益凸显。它不仅是制造业运营的核心,更直接影响着企业的成本与环境的负担。为了降低运营成本、提升经济效益,并实现可持续绿色发展,企业迫切需要降低能源消耗,推进能源管理工作。联合国政府间气候变化专门委员会(IPCC)进行的一项研究表明,在提高组织能源效率和加强碳排放控制这些关键领域加大努力,不仅能应对气候变化挑战,还能为公众健康和经济发展带来长远的益处,预计每年可节省成本超过 3.2 万亿美元。
作者:鲍德宪
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证
-
中药制剂生产设备智改数转的探索与思考













评论
加载更多