中药硬胶囊剂脆碎度改善研究
中药胶囊剂药粉含水量低,吸湿性较强,容易吸收胶囊壳水分,引起胶囊脆碎[1],这是中药硬胶囊剂长久以来一直存在的一个无法克服的质量瑕疵。
本试验重点考察了明胶的不同凝冻强度[2,3]、粘度以及胶囊壳的壁厚[4]对脆碎度的影响。
明胶有骨胶和皮胶[5],均可用于空心胶囊的生产。明胶生产方法有传统的酸法、碱法和盐碱法[6,7],还有新型的酶法[8]。目前80%以上国内明胶的生产均采用碱法。因此本试验从以下两个方面开展了研究:一是筛选合适比例的皮骨混合胶,重点研究了皮骨混合明胶胶囊(7:3)(即70皮:30%骨)、皮骨混合明胶胶囊(3:7)(即30%皮:70%骨)和皮骨混合明胶胶囊(2:8)(20%皮:80%骨),考察其胶囊脆碎度;二是筛选更优的骨胶生产厂家,重点研究了其他传统工艺纯骨明胶生产厂家纯骨明胶胶囊DBG-F,以及新型酶法纯骨明胶宁夏鑫浩源酶法纯骨明胶胶囊的脆碎度。
通过对比现用的纯骨明胶百令胶囊的脆碎度,寻找百令胶囊脆碎度改善最优的方案,从而为中药硬胶囊剂脆碎度改善研究提供重要依据。
1 仪器与试药
仪器:GKF2000S型胶囊填充机[博世包装技术(杭州)有限公司];B1440I型泡罩包装机[乌曼包装技术(上海)有限公司];SHH-250SD型药品稳定性试验箱(重庆市永生实验仪器厂);BCD-521WDPW型冰箱(青岛海尔股份有限公司);胶囊脆碎度检测仪。
试药(第一阶段):发酵冬虫夏草菌粉(杭州中美华东制药有限公司,批号:17111622BL);0#加长罗赛洛纯骨明胶胶囊(安徽黄山胶囊股份有限公司,批号:1803032)的原料来源为罗赛洛纯骨明胶[罗赛洛(广东)明胶有限公司,批号:Y171216];0#加长皮骨混合明胶胶囊(2:8)(安徽黄山胶囊股份有限公司,批号:1801185)的原料来源为罗赛洛纯皮明胶[罗赛洛(温州)明胶有限公司,批号:1573369]和罗赛洛纯骨明胶[罗赛洛(广东)明胶有限公司,批号:Y171116];0#加长纯骨明胶胶囊DBG-F(安徽黄山胶囊股份有限公司,批号:1802117)的原料来源为纯骨明胶胶囊DBG-F(东宝生物技术股份有限公司,批号:Y171210);0#加长宁夏酶法纯骨明胶胶囊(安徽黄山胶囊股份有限公司,批号:1802118)的原料来源为(宁夏鑫浩源明胶有限公司,批号:Y170503)。
试药(第二阶段):发酵冬虫夏草菌粉(杭州中美华东制药有限公司,批号:18053222BL);0#加长皮骨混合明胶胶囊(7:3)(安徽黄山胶囊股份有限公司,批号:1808093)和0#加长皮骨混合明胶胶囊(3:7)(安徽黄山胶囊股份有限公司,批号:1808094)的原料来源均为罗赛洛纯皮明胶[罗赛洛(温州)明胶有限公司,批号:180509]和罗赛洛纯骨明胶[罗赛洛(广东)明胶有限公司,批号:Y170106];0#加长罗赛洛纯骨明胶胶囊(安徽黄山胶囊股份有限公司,批号:1810061)的原料来源为罗赛洛纯骨明胶[罗赛洛(广东)明胶有限公司,批号:Y180712]。
2 方法与结果
将合格的现用罗赛洛纯骨明胶胶囊、纯骨明胶胶囊DBG-F、宁夏酶法纯骨明胶胶囊以及罗赛洛皮骨混合明胶胶囊(2:8)、罗赛洛皮骨混合明胶胶囊(7:3)和罗赛洛皮骨混合明胶胶囊(3:7)填充百令菌粉后,分别在常温、长期稳定性、低温低湿3种条件下存放不同时间后,对其分别进行脆碎度考察。
试验分为2个阶段。
第一阶段考察对象为罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊4个样品,考察时间点为第0月、第1月、第2月、第3月、第4月,以及第6月,对各条件下、各样品分别进行第0~6月合计,并做折线图,优选出脆碎度最优的明胶。
第二阶段考察对象为罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)和罗赛洛纯骨明胶胶囊3个样品,方法同上。
将第一阶段试验优选出的明胶胶囊脆碎度与第二阶段试验进行比较,得出本试验最优明胶胶囊。并综合考虑各方面因素,有选择地应用于生产。
本试验用到的脆碎度考察方法[9]为以下3种。
空心胶囊脆碎度考察:取样品50粒,立即分别逐粒放入直立在木板(厚度2 cm)上的玻璃管内,该玻璃管内径为26 mm(因百令胶囊所用空心胶囊为0#加长,《中国药典》玻璃管直径24 mm不够大,故改用26 mm,以下填充菌粉后胶囊20 g砝码脆碎度和50 g砝码脆碎度测定方法同理),长为200 mm,将重量为20 g的圆柱形砝码(聚四氟乙烯材质,直径为22 mm)从玻璃管口处自由落下,视胶囊是否破裂。
填充菌粉后胶囊20 g砝码脆碎度考察:取样品450粒,立即分别逐粒放入直立在木板上的玻璃管内,将重量为20 g的圆柱形砝码从玻璃管口处自由落下,视胶囊是否破裂。
填充菌粉后胶囊50 g砝码脆碎度考察:取样品450粒,立即分别逐粒放入直立在木板上的玻璃管内,将重量为50 g的圆柱形砝码(聚四氟乙烯材质,直径为20 mm)从玻璃管口处自由落下,视胶囊是否破裂。
2.1 第一阶段试验
第一阶段考察对象为罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊四个样品。对各样品明胶空心胶囊(50粒,20 g)进行脆碎度检测,并用同一批发酵冬虫夏草粉对其进行填充,检测上机合格率。结果见表1-1。
铝塑包装好后,分别在3种条件下存放,并于第0月、第1月、第2月、第3月、第4月,以及第6月分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。存放具体条件见表1-2。
2.1.1 常温条件
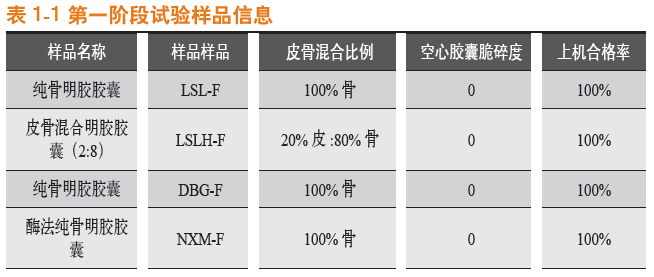
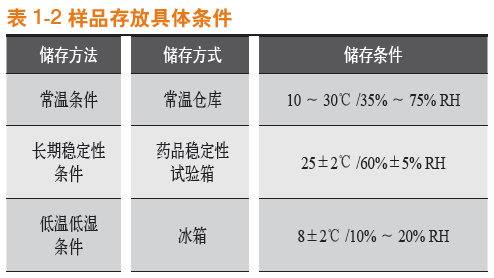
常温条件下存放,于第0月、第1月、第2月、第3月、第4月,以及第6月对罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊4个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表2-1。
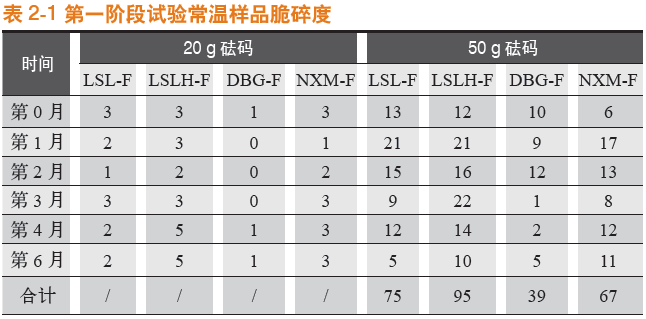
可见,在常温条件下,无论是20 g砝码还是50 g砝码,纯骨明胶胶囊DBG-F(DBG-F)的脆碎度都优于其他胶囊,宁夏酶法纯骨明胶胶囊(NXM-F)和罗赛洛纯骨明胶胶囊(LSL-F)其次,罗赛洛皮骨混合明胶胶囊(2:8)(LSLH-F)脆碎度最差。
第0~6月合计[50g砝码测定下(20g砝码测定下各样品脆碎度均较小,统计学意义较小,下同)],纯骨明胶胶囊DBG-F(DBG-F)比罗赛洛纯骨明胶胶囊(LSL-F)的脆碎度优(低)(75-39)/75即48%。
20 g砝码脆碎度比较见图1-1,50 g砝码脆碎度比较见图1-2。
2.1.2 长期稳定性条件
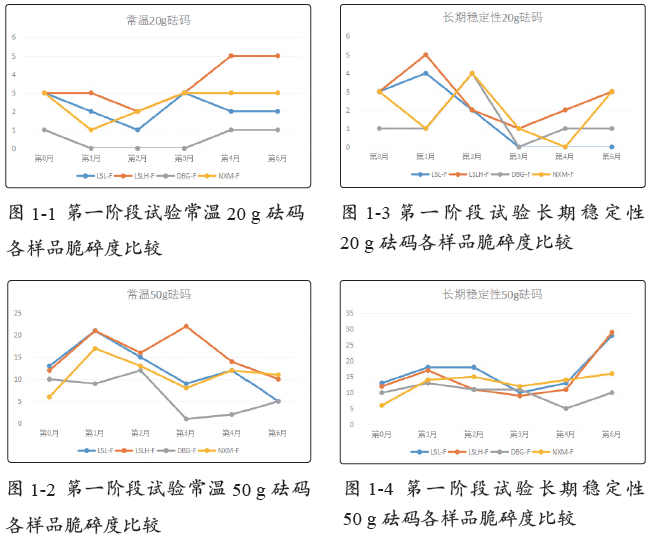
长期稳定性条件下存放,于第0月、第1月、第2月、第3月、第4月,以及第6月对罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊4个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表2-2。
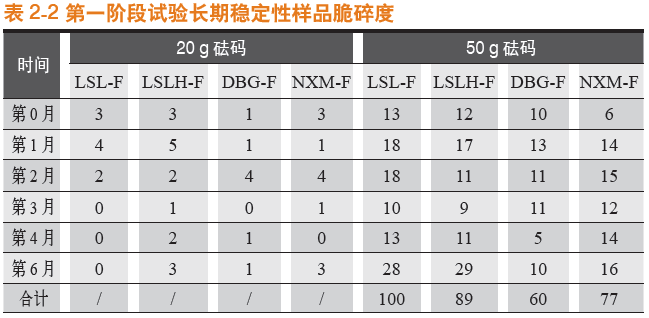
在长期稳定性条件下,各样品20 g砝码脆碎度均不大,故规律性不大。50 g砝码测定结果显示,纯骨明胶胶囊DBG-F(DBG-F)的脆碎度最优,宁夏酶法纯骨明胶胶囊(NXM-F)其次,罗赛洛皮骨混合明胶胶囊(2:8)(LSLH-F)和罗赛洛纯骨明胶胶囊(LSL-F)最差。
第0~6月合计(50 g砝码测定下),纯骨明胶胶囊DBG-F(DBG-F)比罗赛洛纯骨明胶胶囊(LSL-F)的脆碎度优(低)(100-60)/100即40%。
20 g砝码脆碎度比较见图1-3,50 g砝码脆碎度比较见图1-4。
2.1.3 低温低湿条件
低温低湿条件下存放,于第0月、第1月、第2月、第3月、第4月,以及第6月对罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊4个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表2-3。
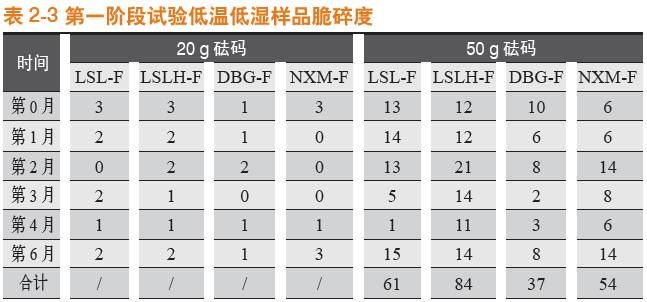
在低温低湿条件下,各样品20 g砝码脆碎度均不大,故规律性不大。50 g砝码测定结果显示,纯骨明胶胶囊DBG-F(DBG-F)脆碎度最优,其次是宁夏酶法纯骨明胶胶囊和罗赛洛纯骨明胶胶囊,罗赛洛皮骨混合明胶胶囊(2:8)(LSLH-F)最差。
第0~6月合计(50 g砝码测定下),纯骨明胶胶囊DBG-F(DBG-F)比罗赛洛纯骨明胶胶囊(LSL-F)的脆碎度优(低)(61-37)/61即39%。
20 g砝码脆碎度比较见图1-5,50 g砝码脆碎度比较见图1-6。
2.1.4 第一阶段试验讨论
从第0~6月合计及折线图来看,罗赛洛纯骨明胶胶囊、罗赛洛皮骨混合明胶胶囊(2:8)、纯骨明胶胶囊DBG-F和宁夏酶法纯骨明胶胶囊这4种样品中,纯骨明胶胶囊DBG-F脆碎度最优,宁夏新型酶法纯骨明胶胶囊在脆碎度改善上并没有特别明显的优势,罗赛洛皮骨混合明胶胶囊(2:8)没有达到改善胶囊脆碎度的预期效果,甚至比现用罗赛洛纯骨明胶胶囊还差。
第一阶段优选出的纯骨明胶胶囊DBG-F,从第0~6月合计(50 g砝码测定下)来看,优于现用罗赛洛纯骨明胶胶囊脆碎度的程度分别为:常温条件下48%;长期稳定性条件下40%;低温低湿条件下39%。
2.2 第二阶段试验
第二阶段考察对象为罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)和罗赛洛纯骨明胶胶囊3个样品。对各样品明胶空心胶囊(20 g,50粒)进行脆碎度检测,并用同一批发酵冬虫夏草菌粉对其进行填充,检测上机合格率。结果见表3-1。
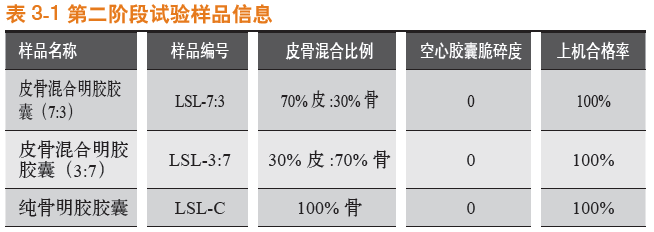
铝塑包装好后,分别在3种条件下存放,并于第0月、第1月、第2月、第3月、第4月,以及第6月分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。存放条件同2.1。
2.2.1 常温条件
常温条件下存放,于第0月、第1月、第2月、第3月、第4月,以及第6月对罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)和罗赛洛纯骨明胶胶囊3个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表4-1。
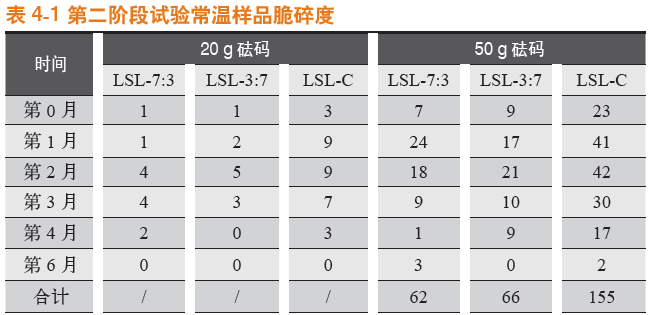
在常温条件下,无论是20 g砝码还是50 g砝码,罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)脆碎度相差不大,均明显优于罗赛洛纯骨明胶胶囊。
第0~6月合计(50 g砝码测定下),罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)比罗赛洛纯骨明胶胶囊的脆碎度分别优(低)(155-62)/155即60%,和(155-66)/155即57%。
20 g砝码脆碎度比较见图2-1,50g砝码脆碎度比较见图2-2。
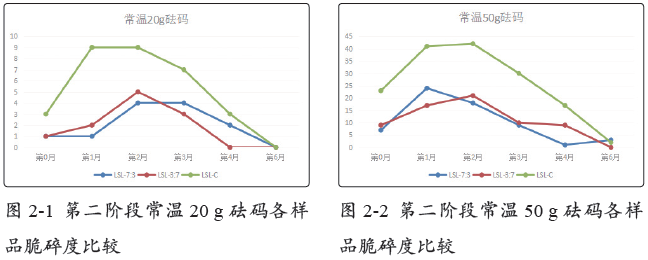
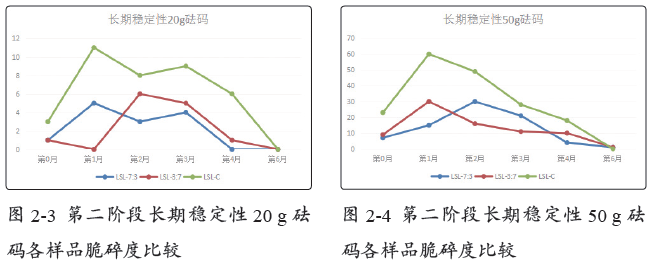
2.2.2 长期稳定性条件
长期稳定性条件下存放,于第0月、第1月、第2月、第3月、第4月,以及第6月对罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)和罗赛洛纯骨明胶胶囊3个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表4-2。
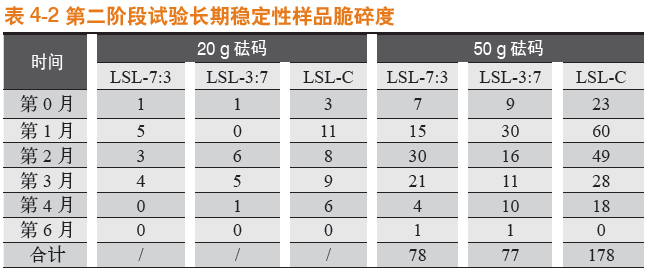
在长期稳定性条件下,无论是20 g砝码还是50 g砝码,罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)脆碎度相差不大,均明显优于罗赛洛纯骨明胶胶囊。
第0~6月合计(50 g砝码测定下),罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)比罗赛洛纯骨明胶胶囊的脆碎度分别优(低)(178-78)/178即56%,和(178-77)/178即57%。
20 g砝码脆碎度比较见图2-3,50 g砝码脆碎度比较见图2-4。
2.2.3 低温低湿条件
低温低湿条件下存放,于第0、1、2、3、4、6月对罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)和罗赛洛纯骨明胶胶囊3个样品分别取样,取样品450粒进行20 g砝码脆碎度考察,取样品450粒进行50 g砝码脆碎度考察。结果见表4-3。
低温低湿条件下,无论是20 g砝码还是50 g砝码,罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)脆碎度相差不大,均明显优于罗赛洛纯骨明胶胶囊。
第0~6月合计(50 g砝码测定下),罗赛洛皮骨混合明胶胶囊(7:3)、罗赛洛皮骨混合明胶胶囊(3:7)比罗赛洛纯骨明胶胶囊的脆碎度分别优(低)(115-40)/115即65%,和(115-57)/115即50%。
20 g砝码脆碎度比较见图2-5,50 g砝码脆碎度比较见图2-6。
2.2.4 第二阶段试验讨论
从第0~6月合计及折线图来看,无论是罗赛洛皮骨混合明胶胶囊(7:3)还是罗赛洛皮骨混合明胶胶囊(3:7),其脆碎度都明显优于现用罗赛洛纯骨明胶胶囊。
第二阶段优选出的罗赛洛皮骨混合明胶胶囊(7:3)和罗赛洛皮骨混合明胶胶囊(3:7),从第0~6月合计(50 g砝码测定下)来看,优于现用罗赛洛纯骨明胶胶囊脆碎度的程度分别为:常温条件下,60%和57%;长期稳定性条件下,56%和57%;低温低湿条件下,65%和50%。
3 讨论
纯骨明胶胶囊DBG-F、罗赛洛皮骨混合明胶胶囊(7:3)和罗赛洛皮骨混合明胶胶囊(3:7)用于百令胶囊生产中,能大大改善百令胶囊脆碎度。而宁夏新型酶法纯骨明胶胶囊在脆碎度改善上并没有特别明显的优势。罗赛洛皮骨混合明胶胶囊(2:8)没有达到改善胶囊脆碎度的预期效果,甚至比现用罗赛洛纯骨明胶胶囊还差。
从两阶段第0~6月合计50g砝码测定下(20g砝码测定下各样品脆碎度均较小,统计学意义较小)来看,使用纯骨明胶胶囊DBG-F、罗赛洛皮骨混合明胶胶囊(7:3)和罗赛洛皮骨混合明胶胶囊(3:7),比使用现用罗赛洛纯骨明胶脆碎度均显著降低,降幅分别为:常温条件下48%、60%和57%;长期稳定性条件下40%、56%和57%;低温低湿条件下39%、65%和50%。
【参考文献】
[1] 邵易珊,赵正荣,邵可众.影响中药胶囊剂囊破裂的因素分析[J].现代中医药,2017,37(1):79-80,100.
[2] 任勇,周涛.硬胶囊明胶质量标准的探讨[J].明胶科学与技术,1995,15(2):94-96.
[3] 张业聪,付丽红.明胶动力影响因素的研究[J].皮革化工,2006,23(6):8-12.
[4] 李承献.明胶在胶囊中的应用[J].明胶科学与技术,2012,32(1):40-46.
[5] 中华人民共和国国家发展和改革委员会.药用明胶.QB2354-2005,2006.
[6] 邓文,邓斌才.骨明胶生产浸灰工艺[J].明胶科学与技术,2007,27(1):16-17.
[7] 曾国爱.我国皮明胶的进展——祝明胶协会成立30周年[J].明胶科学与技术,2010,30(3):113-117.
[8] 吕坪,杜玉枝,魏立新.酶法制备明胶的研究进展[J].明胶科学与技术,2006,26(4):170-172.
[9] 李如栋,覃志高.关于明胶空心胶囊标准中脆碎度检查的建议[J].中国药房,2013,24(9):818-820.
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多