胶囊用明胶稳定性试验考察
在《中华人民共和国药典(2015年版) 四部》(以下简称《中国药典 四部》)“胶囊用明胶”一章中[1]对胶囊用明胶的定义为:动物的皮、骨、腱与韧带中胶原蛋白不完全酸水解、碱水解或酶降解后纯化得到的制品,或为上述三种不同明胶制品的混合物。
《中国药典 四部》在“9001原料药物与制剂稳定性试验指导”[1] 一章中指出:稳定性试验的目的是考察原料药物或制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
长期稳定性试验的基本要求可总结如下:(1)长期试验要求用3批供试品进行;(2)胶囊用明胶是一定规模生产的,每批数量至少应为各项试验所需总量的10倍;(3)长期试验检验标准和检验方法与规模生产所使用的胶囊用明胶的质量标准一致;(4)长期试验所用胶囊用明胶包装应与上市产品一致;(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
1.试验材料
1.1 设施
本次试验所用设施有:成品仓库,温湿度表。
1.2 物料
公司所产胶囊用明胶。稳定性试验所用样品包装与市售包装一致。稳定性试验所用样品贮存在成品库房放置48个月,贮存条件为温度25℃±2℃,湿度60%±10%。
2.方法与结果
2.1 试验方法
选择连续生产的3批,且冻力强度均不低于180 Bloom g的胶囊用明胶开展长期稳定性试验。每一批胶囊用明胶都可视作一个试验组别。
(1)检测周期
每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月取样,按稳定性考察项目进行检测,共检测9次。将检测结果与0个月时的结果进行比较,来确定产品有效期。
(2)考察项目
将性状、干燥失重、冻力强度、勃氏粘度、砷盐、重金属、铬、需氧菌总数、霉菌和酵母菌、大肠埃希菌、沙门氏菌,共11个项目作为考察项目。
2.2 取样方法
由微生物检验员按照公司成品取样SOP规定进行取样,每次每批产品取样2 kg,一共取样6 kg。取样工具包括无菌取样勺和无菌取样袋。
2.3 检测方法
性状,按照《中国药典 四部》中“胶囊用明胶”的【性状】一栏进行检测。
干燥失重,按照《中国药典 四部》中的“0831 干燥失重测定法”进行检测。
冻力强度,按照《中国药典 四部》中的“胶囊用明胶”的【检查】一栏进行检测。
勃氏粘度,按照《中华人民共和国轻工行业标准 药用明胶》QB 2354 -2005 中“5.4 勃氏粘度”进行检测。
砷盐,按照《中国药典 四部》“0822 砷盐检查法”中的第一法进行检测。
重金属,按照《中国药典 四部》“0821 重金属检查法”中的第二法进行检测。
铬,按照《中国药典 四部》“0406 原子吸收分光光度法”中的第一法进行检测。
需氧菌总数、霉菌和酵母菌,按照《中国药典 四部》“1105非无菌产品微生物限度检查:微生物计数法”进行检测。
大肠埃希菌和沙门氏菌,按照《中国药典 四部》“1106非无菌产品微生物限度检查:控制菌检查法”进行检测。
2.4 合格标准
合格标准见表1。
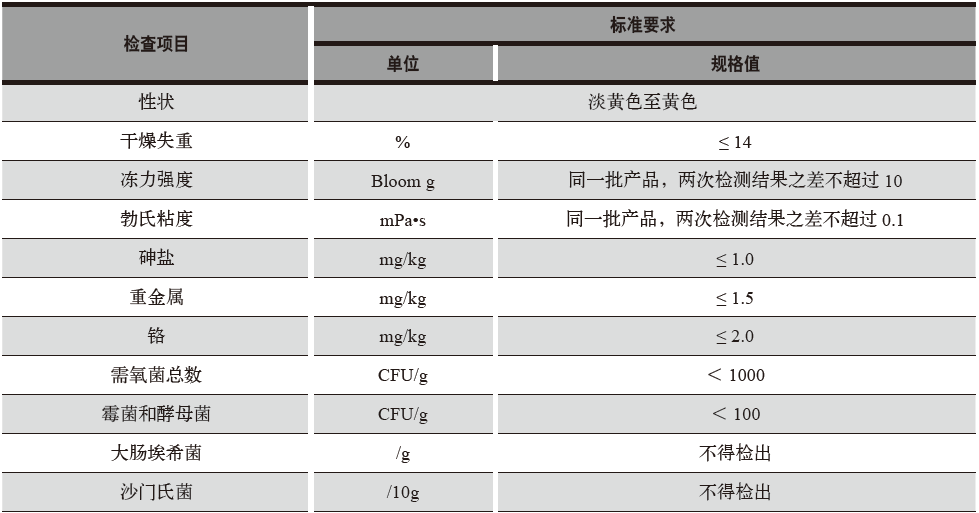
表1 合格标准
2.5 检查结果
按照公司《胶囊用明胶持续性稳定考察管理文件》制定了《胶囊用明胶持续性稳定考察方案》,经审批后实施。3批长期稳定性试验样品,其包装和市售包装一致,储存条件和成品储存条件一致。按照方案进行考察后,发现3批样品的关键质量属性性状、理化指标检查和微生物检查等各项考察指标均符合标准要求。具体的检查结果可见下文“2.6 统计分析”中的(1)-(8)。
2.6 统计分析
(1)干燥失重分析
干燥失重统计与分析,见表2。

表2 干燥失重统计与分析
从2可知:3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,干燥失重这一指标,检测结果均符合标准要求,且第一批9次检测结果极差为0.06、第二批9次检测结果极差为0.1、第三批9次检测结果极差为0.2,说明在现有的包装和储存环境下,胶囊用明胶的干燥失重这一指标十分稳定。
(2)冻力强度分析
冻力强度统计与分析,见表3。

表3 冻力强度统计与分析
从表3可知:3批胶囊用明胶,在0个月、3个月、 6个月、9个月、12个月、18个月、24个月、36个月、48个月时,冻力强度这一指标,检测结果均符合标准要求,且第一批9次检测结果极差为5、第二批9次检测结果极差为4、第三批9次检测结果极差为4,说明在现有的包装和储存环境下,胶囊用明胶的冻力强度这一指标十分稳定。
(3)勃氏粘度分析
勃氏粘度统计与分析,见表4。
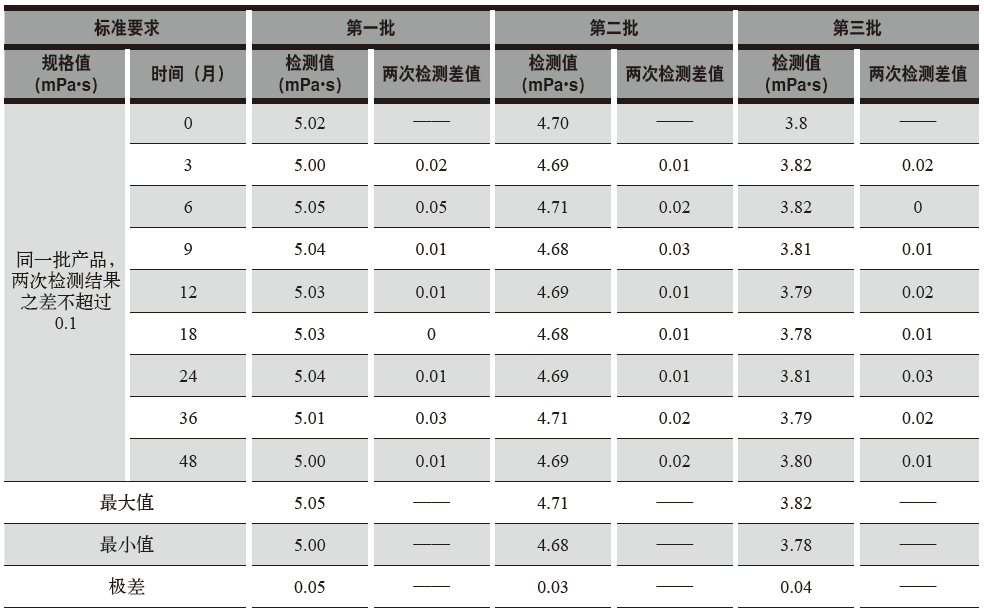
表4 勃氏粘度统计与分析
从表4可知:3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、 36个月、48个月时,勃氏粘度这一指标,检测结果均符合标准要求,且第一批9次检测结果极差为0.05,第二批9次检测结果极差为0.03,第三批9次检测结果极差为0.04,说明在现有的包装和储存环境下,胶囊用明胶的勃氏粘度这一指标十分稳定。
(4)砷盐分析
按标准要求,样品中砷盐的含量应≤1.0 mg/kg。经检测,3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,砷盐这一指标均<1.0 mg/kg,符合标准要求,说明在现有的包装和储存环境下,胶囊用明胶的砷盐这一指标十分稳定。
(5)重金属分析
按标准要求,样品中重金属的含量应≤1.5 mg/kg。经检测,3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,重金属这一指标均<0.5 mg/kg,符合标准要求,说明在现有的包装和储存环境下,胶囊用明胶的重金属这一指标十分稳定。
(6)铬分析
按标准要求,样品中铬的含量应≤2.0 mg/kg。经检测,3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,铬这一指标均<1.0 mg/kg,符合标准要求,说明在现有的包装和储存环境下,胶囊用明胶的铬这一指标十分稳定。
(7)需氧菌总数分析
按标准要求,样品中需氧菌总数应<1000 CFU/g。经检测,3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,需氧菌总数这一指标均<10 CFU/g,符合标准要求,说明在现有的包装和储存环境下,胶囊用明胶的需氧菌总数这一指标十分稳定。
(8)霉菌和酵母菌分析
按标准要求,样品中霉菌和酵母菌含量应<100 CFU/g。经检测,3批胶囊用明胶,在0个月、3个月、6个月、9个月、12个月、18个月、24个月、36个月、48个月时,霉菌和酵母菌这一指标均<10 CFU/g,符合标准要求,说明在现有的包装和储存环境下,胶囊用明胶的霉菌和酵母菌这一指标十分稳定。
3.结论与探讨
本次胶囊用明胶长期稳定性试验研究,通过连续3批胶囊用明胶,验证了公司所生产胶囊用明胶在现有的市售包装形式以及现有的储存环境下,质量可稳定保持48个月。这为公司胶囊用明胶的生产、包装、贮存、运输条件提供了科学依据,同时通过试验建立起了胶囊用明胶的有效期。
【参考文献】
[1]国家药典委员会.中华人民共和国药典(2015年版) 四部[M].北京:中国医药科技出版社,2015:354+547.
邵丽竹
何发
热点文章
-
制药分离技术在生物制药中的应用与探究
2025-12-12
-
中国药典2025年版“药品包装用塑料材料和容器指导原则”的框架体系与核心内容解析
2026-02-04
-
压片制粒生产各过程关键因素之考量
2025-12-22
-
药品共线生产中的清洁验证与风险管控
2025-12-25
-
生物制品分段委托生产情形下的持有人质量管理体系关注点探讨
2025-12-16
-
制药行业未来趋势洞察:数智化、个性化、可持续与全球化重塑产业格局
2025-12-10
-
底喷微丸包衣工艺参数对包衣效果的影响分析
2025-12-04
-
基于CFD仿真技术的灌装机充氮装置设计优化
本文以某制药产线的灌装机设备为研究对象,采用计算流体动力学(CFD)仿真技术对充氮装置的充氮性能进行分析,并结合分析结果对氮幕结构进行了优化设计。随后,针对优化方案进行性能仿真验证,结果显示优化后的顶空残氧量降低至0.252%。为了进一步验证优化方案的实际效果,将优化方案应用于实际产线进行性能测试,测得的顶空残氧量为0.68%,这一结果满足了小于1%的要求,表明其充氮保护性能已达到国际先进水平。
作者:王志刚、刘依宽、刘佳鑫
-
药品密封性检测 :用户需求与优化
-
可控冻融系统在生物原液上的应用
-
人用疫苗生产数字化转型
-
药包材生产质量管理的进阶策略
-
药厂洁净区域风量和压差的控制策略













评论
加载更多