-
数据载入中......
热点文章
-
创新引领未来 合作带来共赢
2021-12-18 0浏览
-
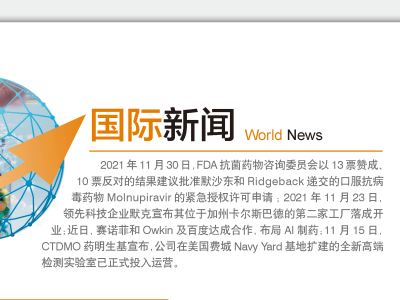
药明生基美国费城扩建实验室投入运营(国际新闻)
2021-12-14 0浏览
-
创新技术引领行业未来新发展
2021-12-15 0浏览
-
2021弗戈制药行业智能制造高峰论坛即将盛大开幕
2021-12-26 0浏览
-
多批次、小批量生产效率提升的新途径
2021-12-21 0浏览
-
如何正确进行仪器性能的确认?
2021-12-19 0浏览
-
下磁力搅拌器在制药行业的应用
2021-12-18 0浏览
-
药品生产如何避免成本陷阱
近几年来,药品生产领域中的成本费用压力越来越高,在业务量成本法的帮助下可以明显地降低成本费。而降低成本的传统方法就是建立瘦身型供应链以及销售物流的外包,但就是这物流合同本身也有着可以节约资金费用的潜力可以挖掘。
作者:制药业
-
2021弗戈制药行业智能制造高峰论坛即将盛大开幕
-
药用活性成分的均质化和干燥
-
寿力 DS系列干式螺杆无油压缩机
-
罗克韦尔 Proxy代理设备
-
塞弗特 洁净型减压阀SV208