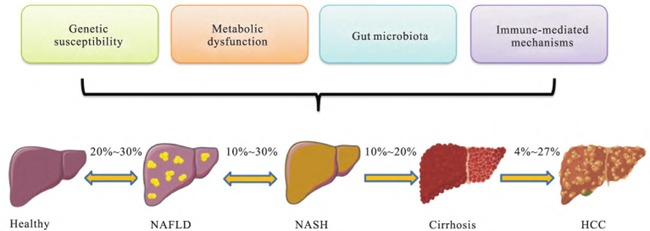
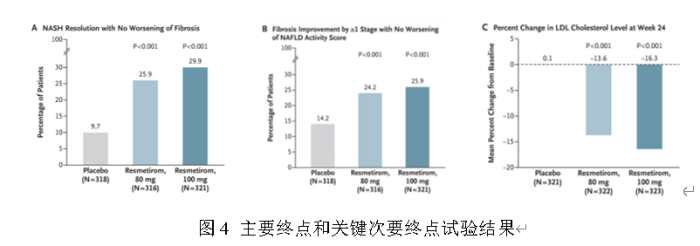
里程碑式新药获FDA批准用于代谢性脂肪性肝炎
撰稿人 | 方知有 药事纵横
责任编辑 | 邵丽竹
审核人 | 何发
热点文章
-
一文读懂:纳米药物的“前世今生”
2024-09-02
-
一文告诉你如何超全面做好清洁验证?
2024-09-04
-
2025版药典有哪些内容变动
2024-09-23
-
深度思考-科学优化湿法制粒工艺
2024-08-28
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
新型抗癌药物剂量选择:从注册剂量到最优剂量的探索
2024-08-27
-
实战解析-化学仿制药注射剂过量灌装(注射液)
2024-09-09
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
近年来,RNA疗法及其在疾病治疗中的潜力备受关注,今年诺贝尔生理学或医学奖授予微小RNA(microRNA)领域的研究更是将这一热度推向高峰。在新药研发蓬勃发展的今天,小核酸药物被视为继小分子药和抗体药之后的“第三次制药浪潮”的关键力量。
作者:崔芳菲
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证
-
中药制剂生产设备智改数转的探索与思考
-
从过程分析技术到药物连续制造













评论
加载更多