利剑显锋芒:2023年Biacore助力FDA获批药物盘点
二十年来FDA第一款完全批准的阿尔茨海默新药
图1:Leqembi (lecanemab-irmb)
2023年1月6日,美国食品药品监督管理局(美国FDA)加速批准卫材 (Eisai) 和渤健 (Biogen) 联合开发的Leqembi (lecanemab-irmb) 用于治疗阿尔茨海默病 (AD) 。Leqembi是针对阿尔茨海默病潜在病理生理学的第二个治疗方法,并被授予快速通道,优先审查和突破性疗法认定。Leqembi是一种人源化免疫球蛋白G1 (IgG1) 抗淀粉样蛋白β (Aβ) 单克隆抗体,能够选择性结合以中和及清除可溶性毒性β淀粉样蛋白聚集体。尽管之前许多针对淀粉样蛋白的药物未能减缓患者智力丧失的速度,但临床研究表明每隔一周静脉注射一次Leqembi,可以去除大脑中的淀粉样蛋白。
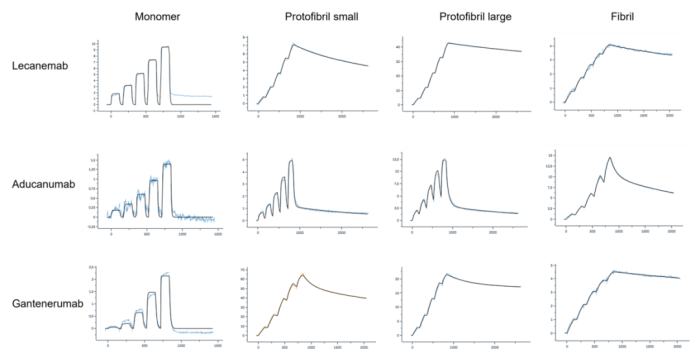
图2:三种抗体与Aβ单体、大原纤维、小原纤维和细纤维的结合动力学传感图
表1:抗体与Aβ单体、原纤维和细纤维的结合动力学数据

在仑卡奈单抗 (Lecanemab) 的研发中,Biacore不仅被用于药靶的亲和力检测,还被用于比较lecanemab、aducanumab和gantenerumab与不同Aβ种类结合的动力学特性。结果表明这三种抗体都能与Aβ单体结合,但亲和力较弱。其中lecanemab亲和力为2300±910 nM,aducanumab亲和力为7300±990 nM,gantenerumab亲和力为1300±480 nM。小编一直在持续关注AD药物的研究进展,更多内容欢迎回顾:☞ AD新药再获批,是突破还是重复争议?
FDA批准的唯一治疗抗AchR抗musk抗体阳性gMG成人的新药
洛利昔珠单抗 (Rozanolixizumab) 是一种皮下注射的人源化IgG4单克隆抗体,以高亲和力特异性结合人类新生儿Fc受体 (FcRn) 。它旨在阻断FcRn和免疫球蛋白G (IgG) 的相互作用,加速抗体的分解代谢并降低致病性IgG自身抗体的浓度。它是美国FDA批准的首个针对成人抗AChR和抗MuSK抗体阳性全身性重症肌无力 (gMG) 的治疗方法。
图3:Rystiggo (rozanolixizumab-noli)
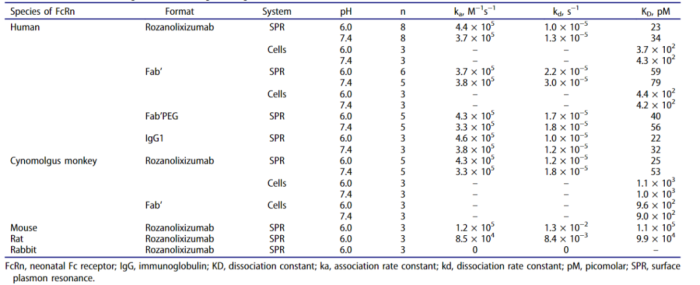
在洛利昔珠单抗的研究中,研究人员通过Biacore全面分析评估rozanolixizumab和各种分子形式 (Fab'、Fab'PEG和IgG) 与FcRn在不同种属、不同PH条件下的结合亲和力。
表2:rozanolixizumab和其他1519.g57形式与不同种类FcRn的结合特性
首个且唯一可广泛应用于婴儿人群的单剂次RSV预防手段
Nirsevimab于2023年7月17日获得美国食品药品监督管理局 (FDA) 批准。Nirsevimab是一种长效单克隆抗体产品,旨在用于新生儿和婴儿,以预防(就医)呼吸道合胞病毒 (RSV) 疾病。

图4:Beyfortus (nirsevimab-alip)
研究人员使用Biacore评估了nirsevimab、MEDI8897、MEDI8897*-TM和帕利珠单抗与一系列FcγR的结合活性。与MEDI8897*相比,Nirsevimab对FcγRI的结合亲和力降低了8.3倍,对FcγRIIA和FcγRIIIA-158V的结合亲和力降低了1.8-2.5倍,这表明YTE修饰导致FcγR结合亲和力适度降低。与MEDI8897*相比,MEDI8897*-TM的结合亲和力大大降低,与FcγRI、FcγRIIA和FcγRIIIA-158V的结合亲和力分别降低了~190倍、~9倍和~5倍。MEDI8897*和帕利珠单抗对所有测试的FcγR都表现出相似的结合亲和力。
表3:SPR检测抗RSVF蛋白Fcγ受体结合的比较
多发性骨髓瘤双抗免疫疗法ELREXFIO
辉瑞 (Pfizer) 公司于2023年8月14日,其创新双抗药物ELREXFIO (elranatamab) 已获得美国食品药品管理局 (FDA) 加速批准,用于治疗复发或难治性多发性骨髓瘤 (R/R MM) 成人患者。ELREXFIO是一种皮下注射的靶向B细胞成熟抗原 (BCMA) 和CD3的双特异性抗体 (BsAb) ,它能与骨髓瘤细胞上的BCMA和T细胞上的CD3结合,使它们结合在一起并激活T细胞杀死骨髓瘤细胞。
图5:ELREXFIO (elranatamab-bcmm)
在该药的研发与申报中,Biacore被用于评估在37 °C下,c与小鼠、大鼠、猴及人类BCMA-Fc以及elranatamab与CD3δε的结合,并且也检测了elranatamab与人类及猴的FcRn的结合亲和力情况。
表4:Elranatamab亲和力动力学表征数据
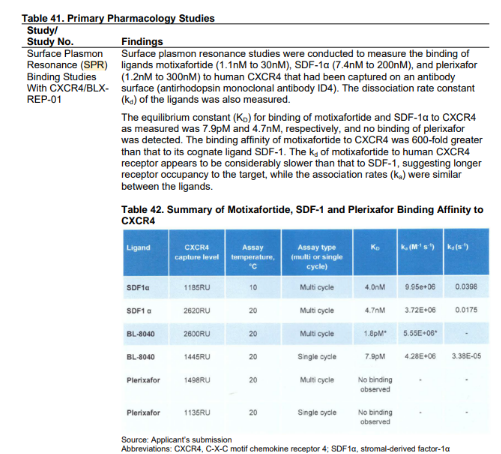
全球首款靶向CXCR4多肽药物APHEXDA
2023年9月8日,以色列BioLineRx Ltd宣布,美国食品药品监督管理局 (FDA) 已批准APHEXDA (motixafortide) 与filgrastim (G-CSF) 联合使用,可将造血干细胞动员至外周血,用于多发性骨髓瘤患者的采集和随后的自体移植。
图6:APHEXDA (motixafortide)
药物研究人员利用Biacore检测了motixafortide、SDF-1α和plerixafor与人CXCR4 结合。Biacore基于的表面等离子共振技术,不仅能检测到分子之间的亲和力,还可以检测到分子间解离速率常数。测定的motixafortide和SDF-1α与CXCR4和其同源配体SDF-1α与CXCR4结合的平衡常数 (KD) 分别为7.9 pM和4.7 nM。motixafortide与CXCR4的结合亲和力比SDF-1α的结合亲和力高600倍。另外,motixafortide与人类CXCR4受体的kd似乎比SDF-1慢得多,这表明motixafortide对靶点的占据时间更长。
表5:motixafortide亲和力动力学表征数据
首款在美获批的国产PD-1产品特瑞普利单抗
2023年10月28日,Coherus BioSciences与君实生物宣布,美国FDA批准其单抗Loqtorzi(toripalimab,特瑞普利单抗)联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌 (NPC) 患者的一线治疗。其单药也获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。特瑞普利单抗是首个FDA批准用以治疗鼻咽癌的PD-1单抗。其亲和力动力学精确表征由Biacore T200测量。
图7:Loqtorzi (toripalimab)
临床前研究中,研究人员使用Biacore比较了特瑞普利单抗和帕博利珠单抗对PD-1的结合亲和力,结果显示,由于特瑞普利单抗结合PD-1后更缓慢的解离率,特瑞普利单抗对PD-1的结合亲和力比帕博利珠单抗高12倍。
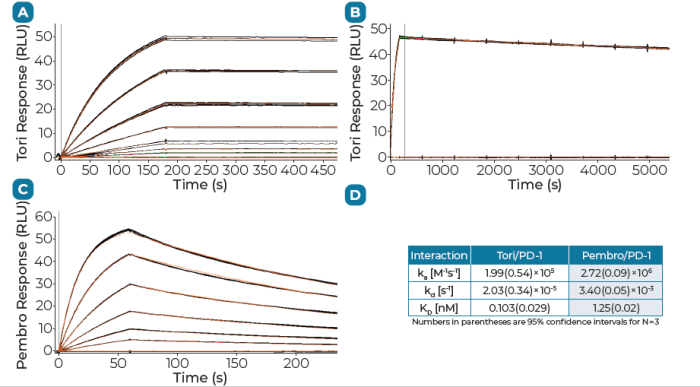
图8:PD-1与共价固定的特瑞普利单抗及帕博利珠单抗结合的Biacore传感图
在该检测中PD-1与tori和pembro结合实验做了3次重复实验,置信度95%。Biacore良好的数据重复性及基线稳定性保证了其申报数据的准确度及可比性。与帕博利珠单抗相比,特瑞普利单抗在T细胞活化和关键免疫系统生物标志物表达水平等方面显著更优。同时,多项临床研究结果也证明了,无论患者PD-L1状态如何,特瑞普利单抗联合化疗均显著改善患者OS。
后续对PD-1的结构分析表明,在N-糖基化位点中,N49、N58、N116三个位点均可观察到糖基化修饰(图9)。 采用芯片上固定有特瑞普利单抗的表面等离子共振(SPR)分析了293T或大肠杆菌表达系统中特瑞普利单抗与PD-1蛋白的结合情况。结果表明,特瑞普利单抗与大肠杆菌PD-1蛋白的结合亲和力 (KD) (KD=0.324 nm) 与293T细胞 (KD=0.238 nm) 无明显差异(图9B、9C)。该结果表明,特瑞普利单抗与PD-1的结合不依赖于任何糖基化修饰。
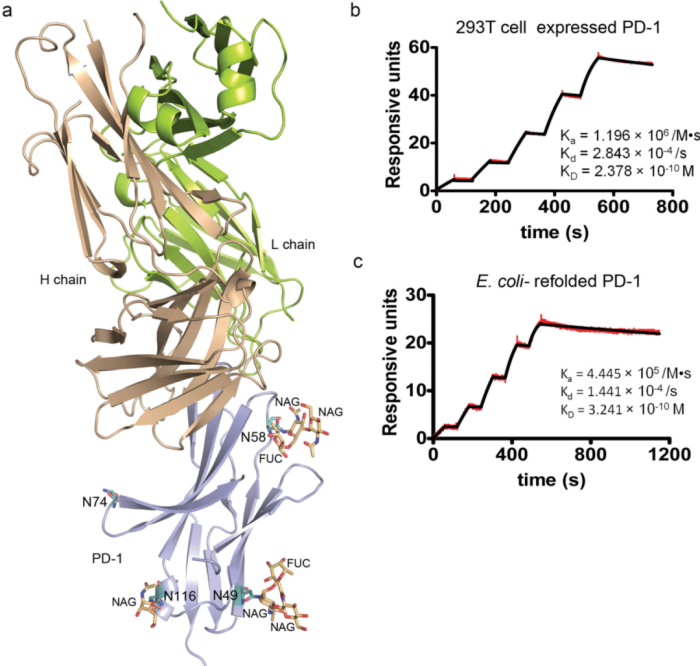
图9:特瑞普利单抗与PD-1结合不依赖于糖基化修饰
全球首款治疗斑块状银屑病的双特异性IL-17 A/F抑制剂
2023年10月18日,优时比宣布IL-17A/F抗体Bimekizumab获得FDA批准上市,用于治疗中至重度斑块型银屑病,商品名为Bimzelx,这也是全球首款IL-17A/F抗体。
图10:Bimzelx (Bimekizumab)
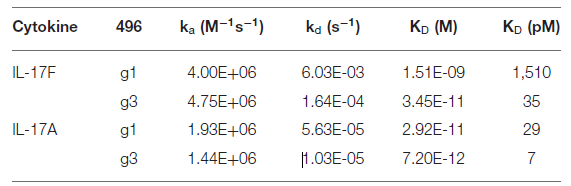
研究人员早期筛选出496.g1,一种与IL-17A具有强亲和力但与IL-17F亲和力较差的人源化抗体。Biacore实验结果显示,经过亲和力成熟后,抗体496.g3对IL-17A和IL-17F的结合亲和力明显增强,分别为7 pM和35 pM,相较于496.g1,分别提高了4倍和43倍。
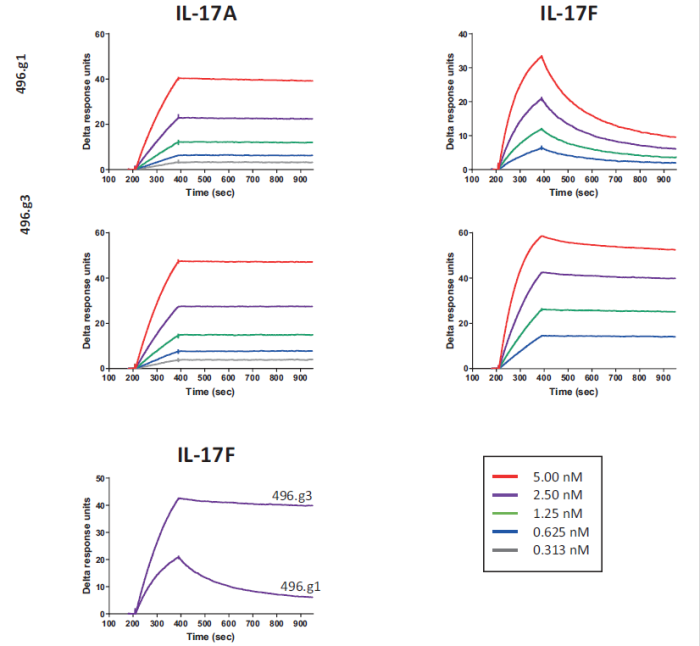
图11:496.g1和496.g3Fab片段的结合亲和力和动力学传感图
表6:496.g1和496.g3Fab片段的结合亲和力和动力学参数
作为IgG1,与IL-17A和IL-17F的亲和力分别为3.2 pM 和23 pM。通过Biacore及体外IL-17A功能测定将496.g3 IgG1与市售抗IL-17A单克隆抗体ixekizumab和苏金单抗进行比较,结果表明496.g3和ixekizumab显示出同等的亲和力对于IL-17A,这两种抗体均明显比苏金单抗更有效。与ixekizumab和苏金单抗相比,496.g3表现出能够中和IL-17F生物活性的独特特征。因此,抗体496.g3因其能够中和IL-17A和IL-17F的生物学功能而被选用于临床开发。
表7:496.g3、司库奇尤单抗和依奇珠单抗对人IL-17A、IL-17A/F和IL-17F的结合亲和力

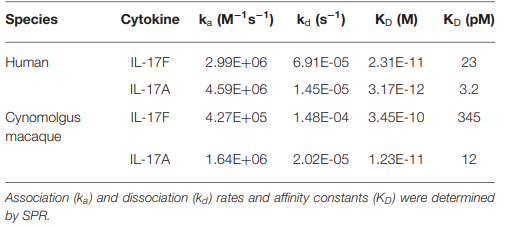
为了能够在灵长类动物中进行毒理学和药代动力学研究,测定了496.g3与食蟹猴IL-17A和IL-17F的亲和力。496.g3对人类和食蟹猴IL-17A显示出相似的亲和性,KD值分别为3.2 pM和12 pM(表8)。虽然食蟹猴IL-17F在345 pM时的亲和力弱于人类IL-17在23 pM时的亲和力(表8),但它被认为足以在灵长类动物研究中进行496.g3表征。
表8:496.g3对人和食蟹猴IL-17A和IL-17F的结合亲和力和动力学参数
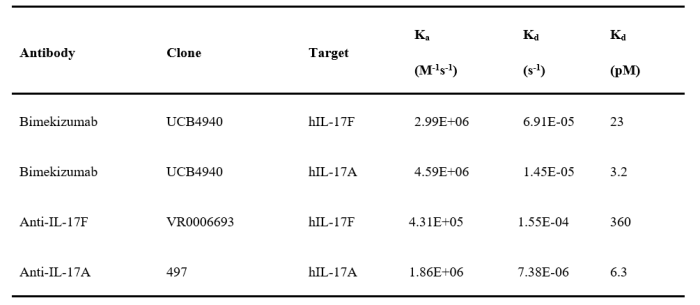
后续研究人员用Biacore评估了bimekizumab对双靶点的亲和力表征,并和抗IL-17A抗体对IL-17A的亲和力进行比较。证明,bimekizumab对IL-17F的亲和力高于抗IL-17F抗体。
表9:bimekizumab对IL-17A和IL-17F的亲和力数据
综上所述,Biacore的检测数据从早期克隆筛选,亲和力成熟,及后续表征,到最后证实抗体496.g3具有对IL-17A和IL-17F的双重中和作用,为整个开发新型双靶点抗体提供了坚实的基础。
首款用于治疗UC的IL-23p19拮抗剂
Omvoh (mirikizumab) 是用来开发的一种人源化IgG4单克隆抗体,被FDA批准用于治疗中重度活动性溃疡性结肠炎 (UC) 成人患者。这是首个用于治疗UC的IL-23p19拮抗剂。此前,该药物已于日本、欧盟、英国等地陆续获批用于中度至重度UC,是礼来首个获批治疗UC的药物。
图12:Omvoh (mirikizumab)
在mirikizumab的表征数据中Miri结合人类和食蟹猴IL-23具有高亲和力,与兔IL-23结合较弱,但不与啮齿动物IL-23或其他IL-23家族成员IL-12、IL-27、或IL-35结合。Biacore证实了mirikizumab对人IL-23具有较高的特异性结合力,而不影响IL-23家族的其他成员,这为后续的药效学研究提供了基础。
表10:mirikizumab的表征数据

在早期抗体筛选对人IL-23具有特异性的抗体时,通过SPR表征了亲和力,首选的小鼠抗体,克隆9F2,被选为IL-23的高亲和力和完全中和剂。9F2成功人源化并优化了亲和力和生物物理特性。得到人源化克隆hu9F2.25,Biacore分析在37℃时提供KD为905 pM。对人源化抗体的进一步CDR优化产生了一组包含四种高亲和力变体的组合 (KD<50 pM) 。基于蛋白质特性,包括亲和力、聚集和表达水平,克隆9F2.25.38 (LY3074828) 被选中并命名为miri。
细胞因子中和抗体最常见的作用机制是阻止与受体的结合。SPR用于检测miri/人IL-23复合物与IL-23R或IL-12Rb1胞外结构域之间的相互作用。Miri有效阻止了IL-23和IL-23R之间的相互作用,但不能阻止IL-23与IL-12Rb1之间的相互作用(表11)。
表11:SPR检测IL-23/IL-23R间相互作用

Biacore很好的证实了Miri是一种高亲和力、中和IgG亚类4变体单克隆抗体,对人IL-23具有特异性,靶向IL-23的p19亚基。中和作用是通过阻止IL-23p19亚基与IL-23受体结合来实现的,并且不影响IL-12途径。
小 结
Biacore在药物研发及申报的各个阶段都发挥着重要作用,从初步的靶点识别到最终的药品上市申请,它为药物开发者提供了一种强有力的工具,以推动药物从实验室走向市场。目前,Biacore基于表面等离子共振技术已经被中国、美国和日本药典收录。2024年也荣幸的被国家药品监督管理局组织制定的《抗体偶联药物药学研究与评价技术指导原则》列为推荐的结合活性检测方法。Biacore技术符合GxP和21 CFR Part 11法规的要求,其准确稳定的数据质量已经得到了药企和监管机构的广泛应用和认可,为企业加快抗体药物上市保驾护航。据不完全统计,超过80%的抗体药物在其早期研发及申报过程中都会用到Biacore。
上市三十多年Biacore一直被各大高校、研究机构及药企坚定的选择原因无他,就在于Biacore始终走在非标记分子互作技术的前沿,为用户提供精准、高效的亲和力动力学检测解决方案。不断优化产品性能,提高检测灵敏度、降低样本消耗,不断扩展在蛋白质研究、药物发现、生物制药等领域的应用。同时,Biacore始终为用户提供全面的技术支持和售后服务,使用户能够轻松应对各种实验挑战。
撰稿人 | Biacore Cytiva思拓凡
责任编辑 | 邵丽竹
审核人 | 何发
热点文章
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
中国药典2025版带来的冲击和影响
2024-10-04
-
洁净工作服清洗、灭菌及使用效期验证
2024-10-14
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
从过程分析技术到药物连续制造
2024-10-30
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
固体制剂高活性车间设计策略
口服固体制剂作为临床应用非常广泛的剂型之一,其传统生产模式存在产尘量大、生产暴露环节众多以及工序复杂等特点。因此,在生产 OEB4-5 级标准的口服固体制剂时,面临的挑战是多方面的。本文从车间建设的角度出发,探讨了针对高毒性或高活性等固体制剂生产所需采取的技术手段与措施。
作者:卞强、陈宁
-
降本增效的能源管理实施建议
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证













评论
加载更多