大规模生物反应器工程设计考量
随着抗体类生物制剂临床用药的快速需求和降本增效,促进了大规模细胞培养工艺的发展和更多应用。但细胞培养在工艺放大时会出现活细胞数量和蛋白产量的下降,并伴随产品质量等属性的改变,为了解决遇到的棘手问题,首先需要大家了解学习搅拌、通气和介质传递对细胞培养工艺的影响。
01
搅拌和通气:
众所周知,哺乳类动物细胞无细胞壁,因此对搅拌和通气比较敏感。在大规模培养时,会伴随搅拌引起的流体动力剪切损伤和底部通气造成的气泡剪切损伤两种机制。主要涉及工艺的3个方面:
1
细胞的剪切损伤
2
介质的不均一性
3
气液相传质不足
所以搅拌和通气是工艺成功运行的关键因素。此外,反应器中培养细胞的剪切力还受到细胞株类别、关键营养物质、抑制细胞代谢的物料浓度和培养周期(例如细胞在停滞期和平台期对剪切力更敏感)的共同影响。
大规模生物反应器的搅拌混合随着规模的增大,罐体中流体体积的增加,整体均匀性混合所需的时间也将变得更长[1]。对于细胞培养工艺过程,搅拌混合是一个大的挑战,剧烈的搅拌混合虽然时间短,但细胞会受到严重的物理剪切损伤;若搅拌混合不充分,会造成罐体中料液的不均一性(例如营养物质、pH和DO的浓度梯度)。所以罐体的混合搅拌转速和剪切损伤、料液均一性等都需要做到平衡。
氧气是需氧生物的关键介质,需要连续供应才能维持细胞的正常培养。与微生物发酵不同,动物细胞的呼吸速率远低于微生物,且不耐剪切。所以动物细胞的剪切敏感性对氧气介质的高传递效率增加了操作限制。另外随着培养规模的变大,氧传递会变得越来越困难,因为所有的搅拌式反应器的传质效率通常会随着规模的增加而降低。此外,大规模反应器中去除细胞呼吸产生的二氧化碳分压的能力也会受到影响[2]。
02
介质传递:
如果不考虑气泡对细胞的剪切损伤,就不能充分理解大规模细胞培养中的传质问题。气泡剪切效应被广泛认为是哺乳类动物细胞在无血清培养基培养时,引起细胞损伤的主要因素。据推测,当气泡在罐体中上升时,细胞会聚集在气泡的气液界面,当气泡在液体表面破裂时,细胞将会暴露于破坏性效应中[3]。一些研究还认为,当细胞被底通气泡捕获并被隔离在表面的泡沫层中时,细胞也会受到剪切损伤。在达到0.05 vvm的气体速率下,会检测观察到气泡的物理剪切损伤。对喷雾气泡影响的研究表明,气体流量比 (VVM) 与细胞死亡率之间存在线性关系[4]。细胞损伤的程度取决于生物反应器的设计和操作,以及细胞株特性、培养基配方和细胞的营养状态。解决气泡损伤的常规方法是添加0.5到3 g/L PF-68,这是一种聚氧乙烯和聚氧丙烯的非离子表面活性剂共聚物。它覆盖在细胞表面,形成保护层,减小气泡的不利影响。因为具有起泡性,PF-68表面活性剂的使用会受到限制,对下游工艺料液处理和氧传质(损失)会有较大挑战。
大规模细胞培养另一个与介质传递相关的问题是随着工艺的运行,CO2分压会持续性上升。高浓度CO2分压会抑制细胞增长,并增加H2CO3的浓度,从而造成更酸性的pH环境。所以大规模比较常见的方法就是在罐体内部或顶通增加空气流速,从而降低CO2分压。Cytiva XDR生物反应器袋子依据客户实际工艺需求配备”T-sparger”,从而降低CO2分压(T-sparger结构示意图1)。
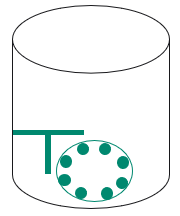
图1
大规模生产用反应器设计应该满足氧传递能力至少要匹配结束培养时细胞密度的氧气利用速率。氧传递能力与溶氧传质系数 (KL a) 成正比关系,KL a与反应器几何尺寸,通气分布设计,罐压和搅拌转速相关。当反应器规模变大时,KL a会有降低的变化趋势。通常情况下,生产规模的KL a是小试(或中试)规模的1/2。为了补偿KL a随着规模增大后降低的情况,可通过氧富集,增加通气流速和提高搅拌等策略缓解该现象。氧富集可以增加气相中的氧气浓度,依据OTR=KL a (C*-C) 公式,氧转移速率与氧传质成正比,其中C为气相中氧气的浓度,C*是与液相平衡的氧浓度;通气流速可以依据VVM(每分钟单位罐体的通气流速:Vessel Volumes per Minute)表征氧气输送到罐体的通气流速和气泡数量,随着氧气流速的增加,可以提高气液相接触面积,从而增加KL a。以Cytiva XDR反应器为例,见图2,可以看到在0.5 mm通气孔径条件下,1 L/min流速比50 ml/min流速的气泡数量和气液接触面积要高很多;在50 ml/min流速和1 L/min流速条件下,20微米通气孔径比0.5毫米通气孔径的气泡数量和气液接触面积要高很多。

图2
通气产生的气泡和泡沫会对细胞造成剪切损伤,增加气体流速和气泡数量的条件有限。因此,机械搅拌是一个好方法。搅拌可以阻止气泡聚集并维持气泡在罐体中较长的滞留时间。可以显著提高KL a系数。见图3所示,在20微米通气孔径,流速11 L/min,1,200 L工作体积 (XDR2000) 条件下,随着搅拌转速从25 rpm上升到115 rpm,KL a也从4 h-1增加到10 h-1。通气和搅拌与KL a呈现出线性关系,因此在反应器特征设计和工艺执行时是关键考量因素。此外大多数规模化反应器细胞培养中,气泡破裂释放的剪切能量至少比混合搅拌引起的剪切损伤大一个数量级。在工艺实际运行过程中,需要重点关注通气所引起的气泡剪切效应问题。
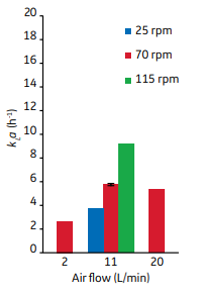
图3
03
混合:
因涡轮式搅拌桨叶物理剪切损伤较大,所以哺乳类动物细胞反应器搅拌桨叶在早期选择了潜水艇搅拌桨叶,但潜水艇搅拌桨叶和涡轮式搅拌桨叶都是径流式叶轮,因此后期陆续开发了有象耳式、矩形式等多类别的轴流式搅拌桨叶,如图4所示。因为轴流式搅拌桨叶和径流式搅拌桨叶相比较,优势是罐体中料液混合更均一(不会有介质梯度分层情况发生),其中Cytiva XDR生物反应器搅拌桨叶如图5所示,该搅拌桨属于轴流式搅拌桨叶设计。
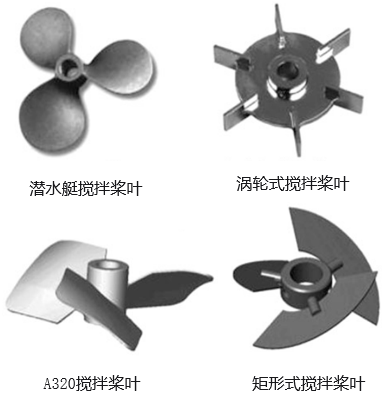

图4
图5
搅拌除了可以实现预期的介质有效混合外,还会引起细胞的损伤。主要原理是:搅拌会引起局部湍流作用,称为漩涡长度 (Kolmogorov) 。漩涡长度公式为:λ4=ν3/ε(λ表示漩涡长度,ν表示流体粘度,ε表示每单位质量的局部消散功率)。当流体中的漩涡长度是细胞直径的1/2-2/3倍情况时,会有明显的剪切损伤作用[5] 。常见的搅拌产生的漩涡长度远大于哺乳类动物细胞直径(动物细胞直径通常是10-30微米之间),而微载体直径是是100-200微米之间,因此,对于微载体贴壁悬浮培养,尤其需要注意搅拌混合产生的漩涡长度。
依据搅拌桨叶设计特征和漩涡长度,我们可知,搅拌混合是一个关键工艺参数的平衡,太剧烈,会有剪切损伤,但搅拌不充足,会造成混合时间延长和物料不均一现象。依据工艺放大公式P/V=NpN3Di5ρ/V (Np=impeller power number, N=agitation speed, Di=impeller diameter, ρ=medium density and V=medium volume) 可以看到,料液的混合能对搅拌转速和桨叶尺寸非常敏感,Np是表征漩涡长度的参数,也可以表征PV值,当流体是湍流情况时,Np是常数,但PV越小(搅拌柔和),流体剪切力也就变小,PV越大(搅拌剧烈),剪切损伤越大。
04
放大:
细胞培养工艺放大除了几何相似性等比例放大外,还会依据VVM(通气流速)和叶尖速度(搅拌转速)进行工艺放大。
对于特定细胞密度的氧气利用效率,会有匹配的最小KL a值,对应的也有氧气转移阈值 (OTT:oxygen transfer threshold) 。如图6所示,当KL a是常数时,通气流速和搅拌转速会对OTT呈现出弧线反比关系 。OTT可以表征每个反应器的设计特征和参数设置,例如通气流速、搅拌转速和KL a之间的指数关系,见图7所示。
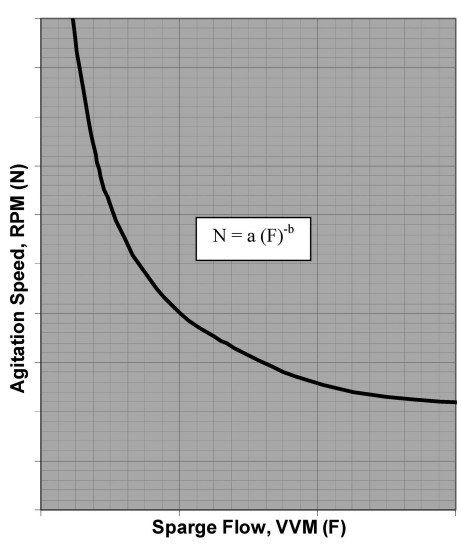
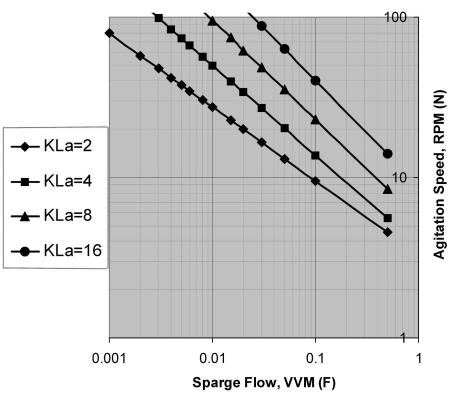
图6
图7
工艺放大时随着细胞密度的增加,操作窗口将变小,直到一个或多个工艺操作约束成为限制因素。放大的目标是使这个操作窗口尽可能大,使每个工艺参数的可操作范围最大化。操作窗口的边界最终必需通过实验确定工艺可允许操作范围,如图8所示。
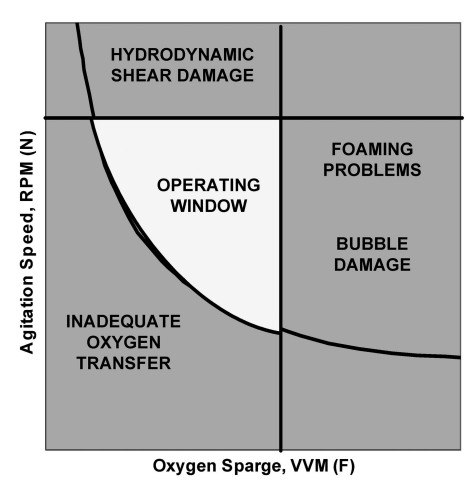
图8
05
通气设计:
常见的底部通气有点分散(大泡或微泡:point sparger)、环分散(大泡:ring sparger)和熔块烧结(微泡:frit sparger)等多种结构设计类别。每个通气结构具有不同的设计理念和工艺表现,但实际的工艺需求是在满足最小介质传递需求的条件下,底部通气可均匀有效分散开,避免气泡在上升过程中聚集,并尽可能的延长气泡的滞留时间,提高溶氧传递效率。
此外,底部通气设计还需要注意气体喷射造成的非搅拌湍流效应,该效应会造成细胞剪切损伤。一个很好的经验是在预期的通气范围内,通气的压力范围维持在0.5-2.5 psi之间。避免压力的急剧变化而产生喷射湍流。Cytiva XDR反应器的通气设计见图9所示,采用通气和搅拌同轴同向设计,确保气泡均匀分散在罐体中,实现高效均一的混合和传质,提高KL a,并减少泡沫的产生。通气底盘具有4种孔径,分别是2微米、20微米、0.5毫米和1.0毫米。灵活多样,可满足多种工艺实际需求和应用。

图9
06
搅拌设计:
搅拌桨叶通常的设计尺寸是罐体直径的1/3-1/2。另外桨叶的结构设计部分在前面已做了内容学习,所以不再赘述。依据在罐体中的搅拌器位点,分别有中心线定位和角度偏心定位2种。
搅拌器中心定位的优势特点是可以在轴杆上安装多个搅拌桨叶,混合时间短,但缺点就是搅拌桨叶在工艺运行过程中,可能太靠近气液界面,会产生漩涡,液体表面的气泡会进入漩涡,从而引起气泡破损而造成的剪切损伤[6]。
角度偏心定位通常是垂直中心线15度,该设计可以避免液体表面产生的漩涡现象,因为有角度,所以在搅拌混合时候,桨叶会受到流体动力影响,造成该设计不能像中心定位一样增加多个桨叶,但罐体底部可以起到挡板作用。
除搅拌桨叶类别和搅拌器位点外,还会在罐体中增加挡板,挡板宽度分别是罐体直径的1/10-1/12,数量是2-4个,从而更加有效的提高均一性混合。其中Cytiva XDR反应器的搅拌桨是15度低搅拌设计,如图10所示,该设计可降低涡流,提升搅拌效率,可以实现真正意义上的20%最小工作体积。
图10
结 语
通过对细胞培养工艺理论知识和反应器设计特征学习,我们知道,大规模反应器工程结构设计需要考虑独特的工艺风险和限制因素。除前面的学习内容外,反应器设计还包括PAT(工艺过程分析技术)在线分析和自动化相关的技术考量, 因篇幅有限,在这里就不再展开分享。如果大家对规模化细胞培养有任何工艺和设备相关的问题,请联系Cytiva本地的上游产品技术支持,我们乐意和大家探讨解决生产工艺中遇到的实际问题。
撰稿人 | Ding Xuquan
责任编辑 | 胡静
审核人 | 何发
热点文章
-
2025版药典有哪些内容变动
2024-09-23
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
中国药典2025版带来的冲击和影响
2024-10-04
-
洁净工作服清洗、灭菌及使用效期验证
2024-10-14
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
固体制剂高活性车间设计策略
口服固体制剂作为临床应用非常广泛的剂型之一,其传统生产模式存在产尘量大、生产暴露环节众多以及工序复杂等特点。因此,在生产 OEB4-5 级标准的口服固体制剂时,面临的挑战是多方面的。本文从车间建设的角度出发,探讨了针对高毒性或高活性等固体制剂生产所需采取的技术手段与措施。
作者:卞强、陈宁
-
降本增效的能源管理实施建议
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证













评论
加载更多