中国医药产业的五大趋势,产业调整,布局海外
趋势(一):我国医药产业在政策利好和资本的推动下基本形成了创新环境,产业进入调整期
2015年,我国对药品审评审批制度进行了升级,建立了4个加速通道,加快推出急需产品。同时,开展药品上市许可持有人 (MAH) 制度,使药品的研发和生产不再捆绑在一起,通过提高上市灵活性提高了行业的创新效率。近年来,创新药纳入国家报销药品目录 (NRDL) 的时间从之前的4-5年缩短到批准当年内。同时,中国设立了两个前沿地区——海南和广港-澳大湾区,加快急需医疗器械进入中国市场,降低制药公司临床研究成本,加快产品商业化。
2022年,药品审评中心 (CDE) 发布了100多份药品研发指南和咨询稿,包括监管肿瘤和罕见病领域临床试验的开展。对于新兴的疗法,如基因治疗、抗体-药物偶联物 (ADCs)、CAR-T细胞疗法、溶瘤病毒疗法等,也提供了有效的指南和法规。
从政策到资本扶持,我国医药产业经历了五年的高速发展。期间,药审中心加快改革,积极引导行业发展。我国各类制药企业一直在提升创新实力,创新药物研发环境基本形成。现在来自 COVID-19 和经济周期下行的挑战,加速了医药行业进入调整期。
趋势(二):2022年,中国新药 IND 数量首次下滑;新兴疗法稳步增长
2022年,我国新药(包括新分子实体和新组合;未正式获批的中药和抗 COVID-19 药不包括在内)申报首次 IND 的数量降至600个,同比下降8%。2018年,国内新药申请首次 IND 的比例为60%,2022年为79%。近五年,国产化药的复合年增长率为15%,国产生物药为26%。
在药物方式上,中国的药物仍以化学药和抗体为主,而新兴疗法的增长变得相对稳定。睿跃生物开发了全球增长最快的 TRK 靶向PROTAC CG001419,用于治疗 NTRK 融合阳性癌症。共有7个放射性药物提出 IND 申请,其中超过一半由中国两大核素药物巨头提交:中国同辐股份有限公司和东诚药业。至于新兴疗法,首次应用于临床试验的细胞疗法45种、抗体-药物偶联物32种、基因治疗13种、RNAi治疗6种。2022年,细胞疗法的 IND 数量同比增长55%,其中84%的产品由中国的生物技术公司研发。
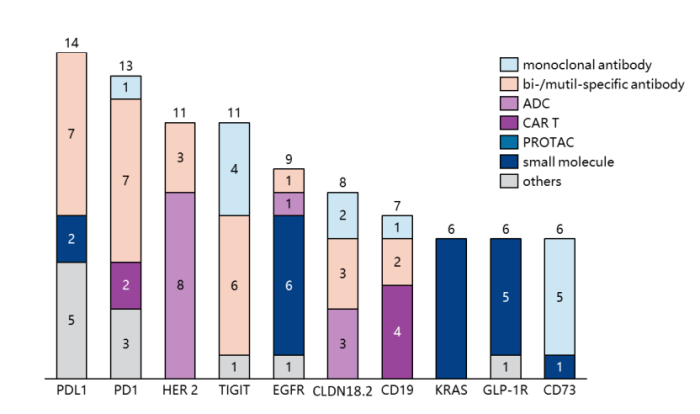
图 2022年IND排名TOP10靶点 来源:PharmaGOTM数据库,NextPharma®数据库
至于申报 IND 的企业,恒瑞医药以19个申报量位居榜首,阿斯利康紧随其后。2021年,前20强公司中只有20%是海外公司,2022年达到35%。此外,生物技术公司提交 IND 的比例显著增加。
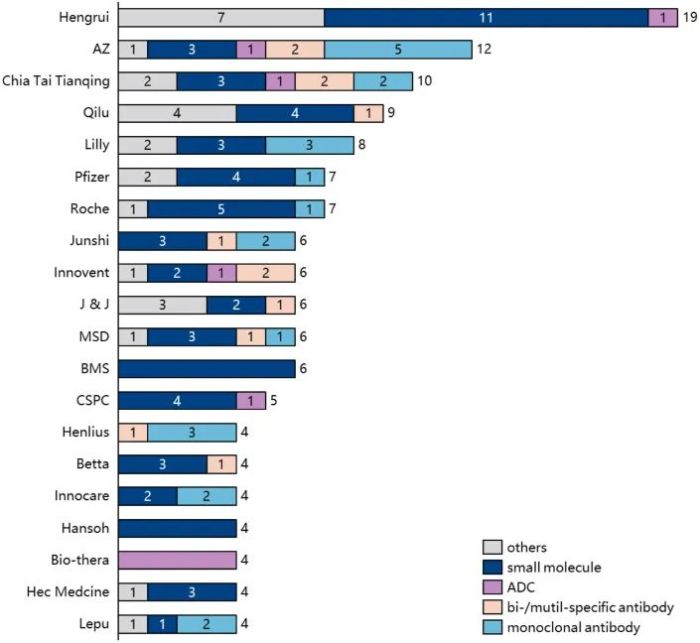
图 2022年IND排名TOP20公司 来源:PharmaGOTM数据库,NextPharma®数据库
趋势(三):新药相关的临床试验数量下降,III期试验数量大幅下降
2017年至2021年,新药相关临床试验数量逐年增长。2022年,上升趋势停止。全年新药临床试验1466项,较2021项(I期693项,I/II期和 II 期472项,II/III期和 III 期301项)同比下降5%。其中,III期试验数量面临最大降幅,同比下降近26%。推测原因是临床管道因现金流不足而萎缩。从公司类型来看,2022年,我国开展三期研究的医药企业数量同比下降35%,生物技术公司同比下降9%。PD1/PDL1 产品上市研发热潮下降应该是背后的原因之一。
趋势(四):NDA数量下降,out-licensed产品已准备好进行上市备案
2022年,我国共有64个新药申请上市,其中24个为国产药,11个为licensed in,5个为licensed out,包括小分子药物 vorolanib 和4个 CAR T 细胞疗法,即Equecabtagene autoleucel,Ciltacabtagene autoleucel、Zevorcabtagene autoleucel和Inaticabtagene autoleucel。一方面,licensed out交易意味着中国的一些国产药品获得了海外市场的认可。另一方面,由于细胞疗法高昂的治疗费用使得中国市场难以覆盖医药企业的研发支出,因此中国企业应该寻求更广泛的市场。目前,中国细胞疗法的研究以生物技术公司为主,与制药公司的合作可以成为降低商业化成本的合理方式。
趋势(五):新药获批数量缩水,国内药企正将目光投向海外市场
2022年,共有50个新药获批(同比下降35%),其中本土药15个,licensed in35个。在批准的本土药物中,小分子药物6个,复方制剂2个,单克隆抗体4个,双特异性抗体1个,疫苗2个。这些药物中约有一半是针对肿瘤学开发的,例如candonilimab是全球首个上市的靶向 PD1/CTLA4 的双特异性抗体,获得美国 FDA 授予的快速通道和孤儿药资格。Candonilimab 表现出比 PD1 靶向单克隆抗体与 CTLA4 抑制剂联合使用更好的疗效和安全性。在中国获批后6个月内,销售额达到5.46亿元。
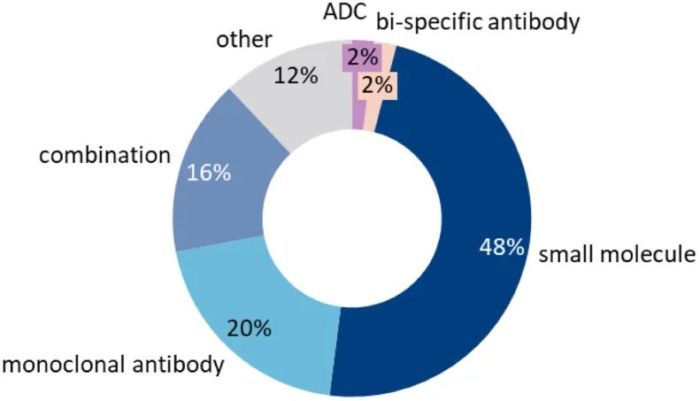
图 2022年NMPA药物分类 来源:PharmaGO™数据库,NextPharma®数据库
从IND、临床试验注册、NDA到药品审批,2022年的数量较2021年有所下降。然而,不应忽视诸如大流行导致2021年临床试验注册上升和2022年 IND 和临床试验数量下降的临床试验积压等因素。目前,医药行业正在调整中,制药公司正在考虑扩大到更大的海外市场。然而在licensed out后,有必要提供具有不同价值的临床试验证据,这要求公司具有合理的临床开发策略和快速推进能力。国内有足够现金流和创新能力的药企需要优先考虑自己的管线,以确保自己的主导地位。拥有宝贵资产的生物技术公司可以考虑寻求合作伙伴来减少费用。未来,随着国内医药企业创新能力的不断提升、政策的利好以及 CDE 对新药的加速通道,我国医药市场正在表现出积极创新和竞争的格局。
撰稿人 | 张虎
责任编辑 | 胡静
审核人 | 何发
热点文章
-
2025版药典有哪些内容变动
2024-09-23
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
中国药典2025版带来的冲击和影响
2024-10-04
-
洁净工作服清洗、灭菌及使用效期验证
2024-10-14
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
固体制剂高活性车间设计策略
口服固体制剂作为临床应用非常广泛的剂型之一,其传统生产模式存在产尘量大、生产暴露环节众多以及工序复杂等特点。因此,在生产 OEB4-5 级标准的口服固体制剂时,面临的挑战是多方面的。本文从车间建设的角度出发,探讨了针对高毒性或高活性等固体制剂生产所需采取的技术手段与措施。
作者:卞强、陈宁
-
降本增效的能源管理实施建议
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证













评论
加载更多