1.具有合适的射线类型和能量。用于治疗的放射性药物中的放射性核素应是发射β或α射线,不发射或少发射γ射线,以提高治疗效果。射线的能量β-应在1 Mev以下,α应在6Mev以下。
2.具有合适的物理半衰期。治疗用的放射性药物半衰期不宜太短,一般在1到10天,以保证疗效。
3.毒性小。要求进入体内的放射性核素及其衰变产物的毒理效应小,若有毒性,应用时要严格控制在无毒性反应的范围内。
目前,拜耳医疗药品公司销售的Xofigo氯化镭(Ra-223)是FDA和欧洲药品管理局(EMA)批准的唯一一种α粒子发射体,用于治疗去势抵抗前列腺癌、有症状的骨转移和未知内脏转移疾病的患者。
作用机制:其活性部分模拟了钙离子,通过与骨骼中的羟基磷灰石(HAP)形成复合物,具有亲骨性,尤其是骨转移病理骨增生活跃的区域。Ra -223发射的α粒子能够在邻近肿瘤细胞中引发高频率的双链DNA断裂,从而产生强效的细胞毒效应。同时,由于其α粒子发射半径小于100微米(不到10个细胞直径),能够最大限度地减少对周围正常组织的伤害。
临床疗效:国际多中心III期研究中,Xofigo联合最佳支持治疗(BSoC)相比安慰剂联合BSoC组可使总生存期延长3.6个月(14.9 vs 11.3个月),并使死亡风险降低30%。此外,与安慰剂相比,以Xofigo治疗的患者首次出现症状性骨骼事件的时间往后推迟(15.6 vs 9.8个月)。治疗组不良事件的发生率与安慰剂组相似甚至更低,提示Xofigo具有良好的安全性。治疗组患者生活质量(QoL)亦得到显著改善。
Xofigo在2020年创造的收入接近3亿美元销售。2020年8月27日, 拜耳公司宣布多菲戈( 氯化镭[223Ra]注射液)获得NMPA批准用于治疗伴症状性骨转移且无已知内脏转移的去势抵抗性前列腺癌(CRPC)患者。
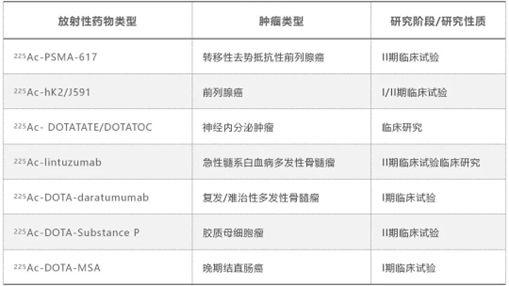
具有10天长半衰期的独特优势。1993年,Geerling等人就提出了将核素213Bi用于225Ac的靶向α核素治疗的概念。在此后的20年里,人们进行了广泛的研究,并进行了大量的临床前研究和几项临床研究。早期的开创性临床工作集中于治疗白血病、非霍奇金淋巴瘤、恶性黑色素瘤、脑肿瘤、神经内分泌肿瘤等疾病。表1展示了目前全球225Ac标记的放射性药物的临床转化情况。
为转移癌性骨痛的治疗剂,主要用于前列腺癌、乳腺癌等晚期恶性肿瘤继发骨转移所致骨痛的缓解,是转移癌性骨痛止痛的一种疗法。1989年和1993年分别在英国和美国应用于临床。我国于2004年获国家药监局批准应用于临床。目前国内该产品的生产企业有中核高通、原子科兴、宁波君安三家。
作用机制:药物进入体内后,可选择性浓聚于骨代谢异常活跃的骨肿瘤病灶部位,病灶对药物的摄取是正常骨的2~25倍,其释放出的β射线对肿瘤细胞具有集中、持久、直接杀伤作用。目前认为其止痛的可能机制为:(1) 治疗使瘤体缩小,减轻了受累骨膜和骨髓腔的压力;(2)辐射生物效应干扰了神经末稍去极化的过程,影响了疼痛信号的传导;(3)辐射生物效应抑制缓激肽和前列腺素等炎性疼痛介质的产生。
临床疗效:治疗疼痛缓解率平均为76%;疼痛完全缓解率平均为32%;
药物名称: 177Lu-DOTATATE(Lutathera)
2017年,诺华以39亿美元收购Advanced Accelerator Applications公司,获得放射性偶联药物177Lu-DOTATATE。177Lu-DOTATATE(Lutathera)是FDA批准的第一款治疗胃肠胰神经内分泌肿瘤的放射性药物,
作用机制: Lutather是 DOTA-TATE肽分子(与奥曲肽相似)通过螯合剂与Lu-177结合,构建成新型复合药物。Lutathera注射到患者体内后,借助受体-配体的靶向识别作用,DOTA-TATE捕捉到肿瘤细胞,继而将放射性核素导入肿瘤组织,Lu-177释放高能量的β射线,最终杀灭肿瘤细胞。
临床疗效:与大剂量奥曲肽相比,177Lu-Dotatate的中位总生存期(OS)延长11.7个月,177Lu-Dotatate组的中位OS为48个月,对照组为36.3个月。
在安全性方面,在长期随访期间,没有关于骨髓增生异常综合征(MDS)或急性白血病的新病例报告。177Lu-Dotatate治疗组的3级或以上肾毒性发生率很低。
2018年FDA获批上市后销售额迅速增长,2021年销售额达4.8亿美元。
药物名称: 177Lu-PSMA-617(Pluvicto)
2018年,诺华以21亿美元收购Endocyte公司,获得小分子靶向放疗前列腺癌药物177Lu-PSMA-617。
作用机制:该药是一种结合了靶向性化合物(配体)和治疗性放射性同位素(放射性粒子)的精准癌症治疗方法。在注入血液后,177Lu-PSMA-617与表达PSMA(一种跨膜蛋白)的前列腺癌细胞结合,因此肿瘤与正常组织相比对药物的摄取率高。一旦结合,来自放射性同位素的辐射(β粒子)就会损伤肿瘤细胞,破坏它们的复制能力和/或触发细胞死亡。放射性同位素的辐射仅在很短的距离内发挥作用,以限制对周围细胞的损害。
临床疗效:与SOC治疗相比,177Lu-PSMA-617联合SOC治疗显著延长了PSMA阳性mCRPC患者的OS和rPFS。具体疗效数据为:(1)OS方面,与SOC组相比,177Lu-PSMA-617+SOC组OS有显著改善(中位OS:15.3个月 vs 11.3个月)、死亡风险降低38%;(2)rPFS方面,与SOC组相比,177Lu-PSMA-617+SOC组rPFS有显著改善(中位rPFS:8.7个月 vs 3.4个月)、组间OS差异(5.3个月)放射学进展或死亡风险降低60%。
安全性方面,177Lu-PSMA-617+SOC组报告的治疗期间出现的药物相关不良事件(TEAE)发生率高于SOC组(85.3% vs 28.8%)。与TEAE相关的停药率方面,177Lu-PSMA-617+SOC组11.9%的患者停用177Lu-PSMA-617、8.5%的患者停用SOC,而SOC组有7.8%的患者停止治疗。
2022年3月23日,诺华宣布其放射配体疗法(RLT)177Lu-PSMA-617获得FDA批准,用于治疗PSMA阳性转移去势抵抗性前列腺癌(mCRPC)患者,商品名为Pluvicto。
发射β、γ射线,β射线用于杀伤肿瘤细胞,γ射线用来示踪显像。I-131具有以下优点:标记物性质稳定;标记方法多样、技术成熟,标记率高;既可以治疗又可以显像;临床使用时间长,经验丰富,相对价格低。
GSK和和Corixa公司联合开发131I-托西莫单抗(Bexxar)于2003年6月27日获FDA批准上市,用于治疗CD20阳性复发或难治性、低级、滤泡或转化的非霍奇金淋巴瘤。
作用机制:托西莫单抗是放射性物质131I标记的抗CD20的鼠单克隆抗体,能与表达于B细胞非霍奇金淋巴瘤上的CD20抗原结合,并通过放射性元素诱导肿瘤细胞凋亡。
临床疗效: 5项临床研究结果证实,Bexxar的抗肿瘤反应时间平均可持续14个月,30%的患者体内完全检测不到癌细胞,而在大约8年的随访期间这些患者中有70%以上没有复发。
2014年由于商业原因, 葛兰素史克已经停止生产托西莫单抗的生产和销售。
成都华神生物开发的131I-美妥昔单抗注射液是全球第一个用于治疗不能手术切除或术后复发的原发性肝癌,以及不适宜作动脉导管化学栓塞(TACE)或经TACE治疗后无效、复发的晚期肝癌患者癌的药物,也是我国第一个具有自主知识产权的抗体类药物,商品名为利卡汀,2011年在中国上市。
作用机制:美妥昔单抗可与分布在肝癌细胞膜蛋白中的HAb18G/CD147抗原结合,将其荷载的放射性碘[131]输送到肿瘤部位,利用β射线对肿瘤细胞近距离、长时间杀伤,从而特异性杀死肿瘤细胞而不伤及正常组织。
临床疗效: 103例无对照开放II期临床研究结果显示本品对晚期原发性肝癌的控制率(CR+PR+MR+SD)超过80%。根据临床经验,一般晚期肝癌发展很快,其稳定期极少能超过一个月,由此判断本品对晚期肝癌是有一定疗效的。故推荐本品适用于不能手术切除或术后复发的原发性肝癌,以及不适宜TACE或经TACE治疗后无效、复发的晚期肝癌患者。尚未进行大规模的随机对照临床研究。
2023年4月10日,远大医药发布公告,宣布其放射性核素偶联药物(RDC)TLX101获国家药监局批准开展I期临床,用于治疗胶质母细胞瘤。
作用机制:TLX101 (131I-IPA)是Telix公司基于放射性核素-小分子偶联技术开发的一种用于治疗胶质母细胞瘤的放射性药物,可自由通过血脑屏障进入大脑,并靶向胶质母细胞瘤过度表达的L型氨基酸转运蛋白1(LAT-1)精准辐射癌细胞,促使其凋亡以达到治疗效果。
目前获批上市的钇[90Y]有5种,其中包括两种微球,氯化钇、柠檬酸钇,以及90Y-替伊莫单抗。与其他放射性同位素相比,90Y发射纯β射线,不产生γ射线,对医护人员及患者家属非常安全。
微球由放射性核素90Y和微球载体两部分组成,获批上市的包括Sirtex Medical的SIR-Spheres Y-90树脂微球和波士顿科学的钇90玻璃微球,二者在其组成、
直径大小和放射性活度规格等方面有差异。其中,SIR-Spheres Y-90树脂微球在美国和欧洲多地获批,用于治疗肝脏恶性肿瘤。2022年1月,SIR-Spheres Y-90树脂微球获NMPA批准用于经标准治疗失败的不可手术切除的结直肠癌肝转移患者的治疗,也是中国首个批准用于治疗结直肠癌肝转移灶的放射性栓塞药物产品。
作用机制:体内放射疗法(SIRT)又称放射性栓塞,该方法将数百万个Y-90树脂微球直接植入到肝脏肿瘤中。放射活性元素Y-90发出β射线杀死肿瘤。正常肝脏组织血供约90%来自门静脉,而肝脏肿瘤约90%血供来自肝动脉。SIR树脂微球经肝动脉直接靶向作用于肝脏肿瘤,从而使其他正常肝脏组织受到放射的风险降到最低。
临床疗效:1项1103例临床研究证实,钇[90Y]树脂微球联合化疗组和单独化疗组的ORR分别为72.2%和63%。钇[90Y]树脂微球能显著提高肿瘤反应率,使患者肿瘤缩小、降期并重获肝切除术机会;显著延长肝脏无进展生存期,控制患者肝脏肿瘤进展,增加等待肝移植手术的时间。同时,钇[90Y]树脂微球副作用较小、患者生活质量较高。
90Y-替伊莫单抗是替伊莫单抗通过稳定的巯基共价键,与螯合剂tiuxetan化学结合,与90Y形成稳定的、具有严格构象的络合物,2002年被FDA获批用于复发的或顽固性低度恶性非霍奇金氏淋巴瘤患者的治疗,是第一个FDA 批准的放射免疫治疗药物。
作用机制:替伊莫单抗可特异性地与CD20抗原结合。CD20抗原在前体B细胞,成熟B淋巴细胞,和超过90%B细胞非霍奇金淋巴瘤(NHL)细胞中表达。替伊莫单抗螯合物紧密结合Y-90放射性元素,Y-90释放β射线通过在靶细胞及邻近细胞形成自由基而诱导细胞死亡。
临床疗效:一项单组研究包括54例使用利妥昔单抗治疗不佳的复发性滤泡性非霍奇金淋巴瘤患者。主要疗效评价终点为总有效率(ORR),疗效持续时间 (起效至疾病发展的时间间隔,DR)。
结果显示,ORR为67%,平均DR为11.8个月(4~17个月)。
目前,全球从事放射性药物的企业数量相对较少,主要是受限于放射性同位素生产和供给的影响。全球领先的放射性药物生产企业有诺华、拜耳、GE、Cardinal health、UPPI、RadioMedix、Lantheus等。国内放射性药物缺少拥有自主知识产权的创新药,且研发速度较慢,但随着国内加大对放射性药物及相关设备开发的支持,未来会有越来越多的企业开始进入放射性药物的开发行列,为患者提供更好、更精准的诊断和治疗手段。
1. 2020肿瘤新药数据卡——氯化镭[223Ra],医药魔方
2. 中国225Ac放射性药物前期临床转化,中国核技术网
3. 氯化锶[89Sr]治疗转移性骨肿瘤专家共识
4. 肠道神经内分泌肿瘤最新治疗!177Lu-Dotatate极大改善生存结果
5. 前列腺癌创新疗法!PSMA靶向配体放射疗法177Lu-PSMA-617 III期研究成功:显著延长患者生命!
6. 远大医药first in class放射性核素偶联药物获批临床,医药魔方
7. 肿瘤克星!放射性药物的研究现状及前景展望
来源:药事纵横
责任编辑:胡静 审核人:何发













评论
加载更多