药品稳定性试验
定 义 及 目 的
稳定性试验的定义,从字面上来看,就是看生产出来的药品在一定的条件下存放是否稳定。
通常稳定性试验可以分为三个大类:
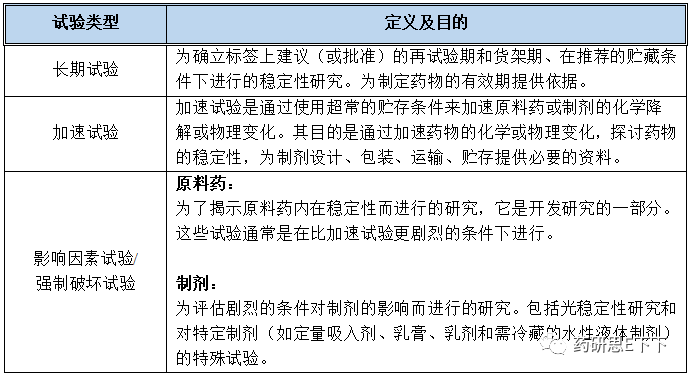
从上述表格可以看出,对于长期试验、加速试验以及影响因素试验/强制破坏试验来说,每个试验的条件是依次变得更加苛刻的,在试验的过程中,将为我们提供一系列相应的数据,来判断生产出来的药品在拟定的储存条件下是否稳定,是否可以长期保存,进而制定出产品的有效期。
如 何 做 ?
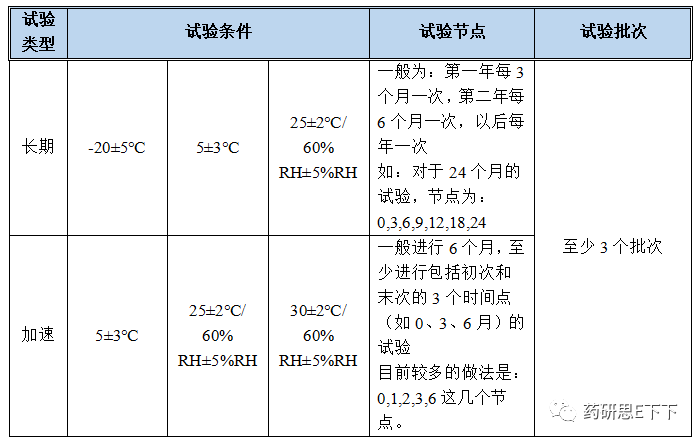
影响因素试验/强制破坏试验:
通常1批即可,如果试验结果不明确,则应加试2个批次样品。生物制品应直接使用3个批次。
高温试验:
条件:60℃温度下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。若供试品含量低于规定限度,则在40℃条件下同法进行试验。若60℃:无明显变化,不再进行40℃试验。
高湿试验:
在25℃分别于相对湿度90%±5%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。若吸湿增重5%以上,则在相对湿度 5%±5%条件下,同法进行试验;若吸湿增重5%以下,其他考察项目符合要求,则不再进行此项试验。
强光照射试验:
放在装有日光灯的光照箱或其他适宜的光照装置内,光源可选择任何输出相似于 D65/ID65发射标准的光源,或同时暴露于冷白荧光灯和近紫外灯下,并于照度为4500Lx±500Lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。
数 据 评 价
上面介绍了如何进行稳定性试验,下面给大家介绍如何判断稳定性试验的结果以及评价稳定性试验。
我们在评价所有东西的时候都是需要一个评判的标准的,那么对于评价稳定性试验数据的评判标准是什么呢?
就是看这些数据是否有显著变化、异常趋势,是否在质量标准范围内。
在ICH Q1A(R2) 新原料药和制剂的稳定性试验中分别对原料药和制剂稳定性试验数据的显著变化进行定义,已确定什么时候需开展中间条件试验或考虑缩短效期或改变储存条件。
对于原料药来说,数据有显著变化即指超出质量标准范围。
对于制剂来说,数据有显著变化通常定义为:
①含量与初始值相差5%;或采用生物或免疫法测定时效价不符合规定;
②任何降解产物超过标准限度要求;
③外观、物理常数、功能试验(如颜色、相分离、再分散性、粘结、硬度、每揿剂量等)不符合标准要求。然而,一些物理性能(如:栓剂的变软、霜剂的熔化等)的变化可能会在加速试验条件下出现;
④对于某些剂型,pH值不符合规定;
⑤12个制剂单位的溶出度不符合标准的规定。
如果稳定性试验出现上面所说的“显著变化”怎么办呢?
对于长期试验:
如果试验数据出现“显著变化”,比如对于5±3℃保存的产品,含量在第18个月不符合要求了。那么通常可以采取减短效期或者改变储存条件来解决,比如将有效期定为12个月,或者将储存条件进一步控制到-20±5℃。
对于加速试验:
加速试验还可以被用来评价稳定性试验数据,如果长期试验以及加速试验均符合要求的情况下,
如长期试验进行了6个月,加速试验6个月,结果均未出现显著变化的情况,那么制定有效期时,可以进行外推,这个时候就可以制定为12个月的有效期,也就是2倍的长期试验月数。但是这种外推最多不能超过12个月,对于冷藏产品,最长外推的时间不能超过6个月,对于冷冻产品是不能进行外推的。
在ICH Q1E 稳定性数据的评价中有清晰的决策树,来帮助大家实现产品有效期的外推。决策树内容如下:
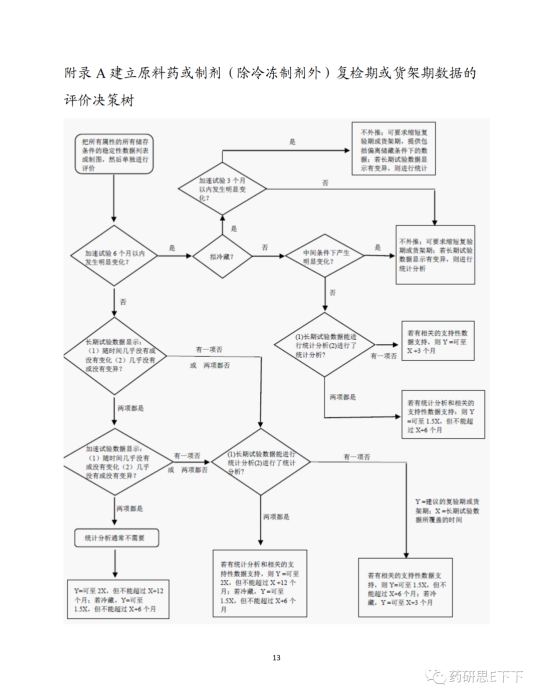
如果加速试验不符合要求呢,一方面可以通过进行中间试验的方式,来满足注册申报的要求,也就是在长期试验和加速试验条件的中间选择一个中间条件继续进行试验,但如果中间试验还是不能满足要求的话,这时就需要考虑自己产品的储存条件了。
此外,加速试验数据往往还能被用于评价产品运输过程中短时间的温度超标,用来提供数据支持。
对于影响因素试验/强制破坏试验:
影响因素试验结果超标准是很正常的,因为这个试验主要的目的就是为了研究产品中杂质属性、杂质变化等信息而做的,因此即使试验超标了也是可以正常进行申报的。
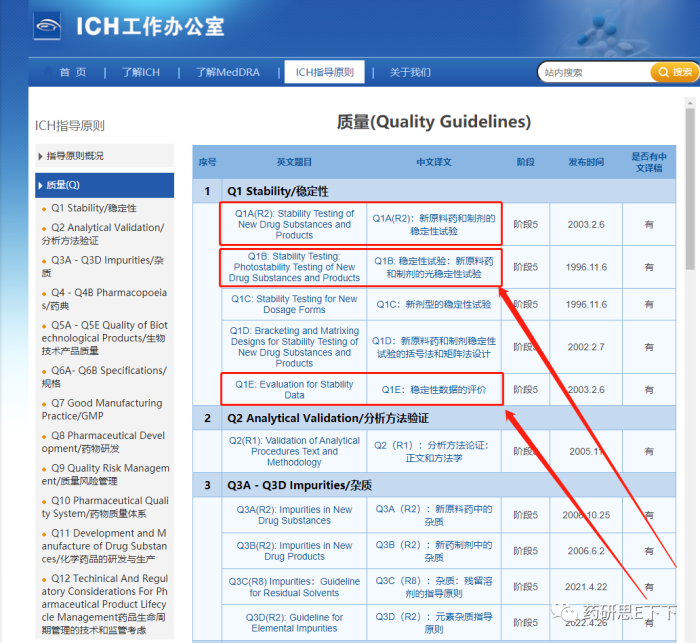
ICH 指南中,质量模块第一部分便是稳定性试验详见下图:
内容来源:药研思E下下
责任编辑:胡静 审核人:何发
热点文章
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
中国药典2025版带来的冲击和影响
2024-10-04
-
洁净工作服清洗、灭菌及使用效期验证
2024-10-14
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
从过程分析技术到药物连续制造
2024-10-30
-
固体制剂高活性车间设计策略
口服固体制剂作为临床应用非常广泛的剂型之一,其传统生产模式存在产尘量大、生产暴露环节众多以及工序复杂等特点。因此,在生产 OEB4-5 级标准的口服固体制剂时,面临的挑战是多方面的。本文从车间建设的角度出发,探讨了针对高毒性或高活性等固体制剂生产所需采取的技术手段与措施。
作者:卞强、陈宁
-
降本增效的能源管理实施建议
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证













评论
加载更多