迄今商业化最成功的ADC:Kadcyla

中国首个上市ADC—— Kadcyla®
罗氏Kadcyla®(ado-trastuzumab emtansine,恩美曲妥珠单抗,赫赛莱®)是我国首个上市的抗体药物偶联物(ADC),也是全球首款被批准用于实体瘤的ADC。
它的全球首次上市是在美国,2013年获得FDA批准,用于早期和转移性HER2阳性乳腺癌的二线治疗。
Kadcyla为白色至类白色无菌冻干粉末,用于静脉输液,规格为100mg/瓶;160mg/瓶。
按照疾病情况、体重给药,用法用量如下:
推荐剂量为3.6mg/kg,采用静脉输注,每3周一次,即21天为一个周期。
给予起始剂量时,采用90分钟静脉输注;如果既往输注耐受性良好,则给予后续剂量时,可采用30分钟输注。
早期乳腺癌患者接受共14个周期治疗,晚期乳腺癌患者应持续治疗,直至疾病复发或出现无法控制的毒性。

第二代ADC的代表药物

* 说明:关于“不可切割连接子”、“旁观者效应”解释不赘述,详见文末【往期文章】。

Kadcyla临床疗效和市场表现

(KATHERINE研究临床数据,来源:Kadcyla说明书)


国内外竞品
上市

在研
3. SHR-A1811
原研:恒瑞医药
靶点:HER2
药物/有效载荷:DXd系列
适应症:乳腺癌、肺癌、实体瘤等
研究状态:临床3期
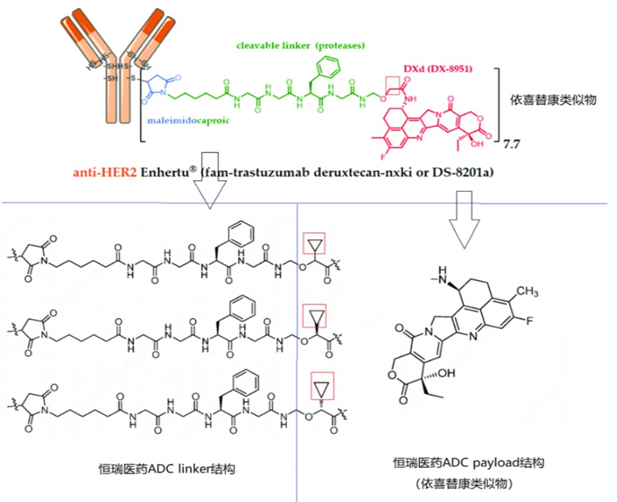
SHR-A1811毒性药物(有效载荷)采用了DXd系列药物,一种依喜替康(Exatecan)衍生物,属于DNA拓扑异构酶I抑制剂。
据恒瑞专利,SHR-A1811与第一三共的Enhertu具有几乎一致的连接子和毒性药物,它与Enhertu的区别在于,在DXd同类药物的α位引入了一个环丙基。
前不久,6月中国药物临床试验登记与信息公示平台显示,恒瑞医药SHR-A1811已经启动乳腺癌的临床研究III期。旨在评价在晚期阶段,接受过曲妥珠单抗和紫杉类药物治疗的HER2 阳性转移性乳腺癌患者中,SHR-A1811的无进展生存期是否优于吡咯替尼联合卡培他滨。
总结
这一期我们了解了商业化最成功的ADC:Kadcyla,它也是首个批准用于实体瘤的ADC。2021年Kadcyla的亮眼业绩,亦证明了它在ADC中的重磅地位。
来源:BiG生物创新社
热点文章
-
可见异物、不溶性微粒、澄清度——傻傻分不清
2024-08-17
-
一文读懂:纳米药物的“前世今生”
2024-09-02
-
质量源于设计在药物制剂设计中的应用
2024-08-19
-
深度思考-科学优化湿法制粒工艺
2024-08-28
-
一文告诉你如何超全面做好清洁验证?
2024-09-04
-
2025版药典有哪些内容变动
2024-09-23
-
新型抗癌药物剂量选择:从注册剂量到最优剂量的探索
2024-08-27
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
近年来,RNA疗法及其在疾病治疗中的潜力备受关注,今年诺贝尔生理学或医学奖授予微小RNA(microRNA)领域的研究更是将这一热度推向高峰。在新药研发蓬勃发展的今天,小核酸药物被视为继小分子药和抗体药之后的“第三次制药浪潮”的关键力量。
作者:崔芳菲
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证
-
中药制剂生产设备智改数转的探索与思考
-
从过程分析技术到药物连续制造













评论
加载更多