全球药审数据:中国、欧洲、美国批文情况详细解构!
如果按照一个完整的好莱坞式剧本来推演2015年全球药物审评市场,一般的故事情节设计是:一个精彩的开始,以及一个完美的演进,接下来就可以期待一个完美结局。当然,这个设计是在没有突发事件的背景之下。
2015年,对于欧美和中国来说,故事的脉络走向显然与预期有所不同。首先是美国,在经济逐渐企稳并好转之际,剧情的发展却没有出现意外的好莱坞式剧本走向。欧洲虽然经历经济下滑和难民潮的冲击,故事的走向却依然出现好莱坞喜剧式结局。国内的经济虽处于转型期,但作为全球增速最快的经济体,医药市场的变化显然出乎人们意料。在经历严重药物注册申请积压之后,近期各类重磅政策陆续出台,标志着故事的脉络走向完全不同于往年,有了一个全新的结局。
中国: 获批数量少成常态
2015年获得批文数量呈现前高后低的态势,特别是下半年,批文数急剧减少
在经历2014年的药物创新热潮之后,2015年迎来的是严峻的政策年。对各企业而言,犹如经历了一场过山车般的感受,由年初的志在必得、以期获得更多的批文储备,到接近年终之际数十个品种因各种不规范遭遇CFDA不予批准,以及数以百计的药品注册申请撤回的公告陆续发出。这或许标志着医药市场的真正洗牌正式拉开了序幕。
米内网审批数据库显示,2015年国内企业获得批文数量呈现前高后低的态势,特别是下半年,批文数急剧减少。由于不少企业递交的申报资料中有作假的情形存在,药物批准趋严在所难免,批文数量少或许在2016年成为常态。
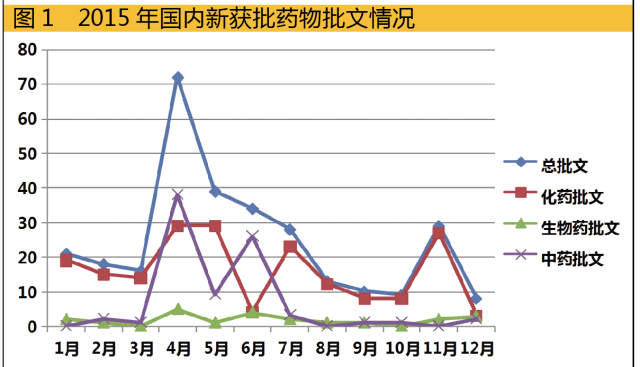
从批文数量来看,2015年获批数量远远少于2014年;从获批的创新性药物数量来看,也不如2014年。2015年创新性的看点来源于生物药,3个1类新药的批文傲视中药和化药。全球首个Sabin株脊髓灰质炎灭活疫苗(单苗)的获批,不仅标志着我国此类技术已打破脊灰灭活疫苗生产技术的垄断,还填补了国内脊灰灭活疫苗生产领域的空白。
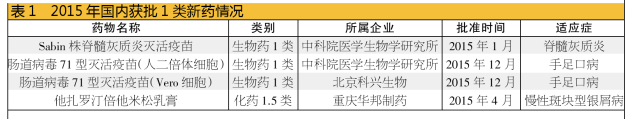
从企业获批批文数量来看,超过5个批文的企业只有6家,而且青岛华仁虽拥有5个批文,却只是一个品种的5个规格。最得意的是重庆圣华曦,获得了10个批文,包含6个品种;其余依次为重庆余庆堂9个批文,包含3个品种;山东罗欣6个批文,6个品种;重庆华邦及湖南方盛各5个批文,各包含3个品种。
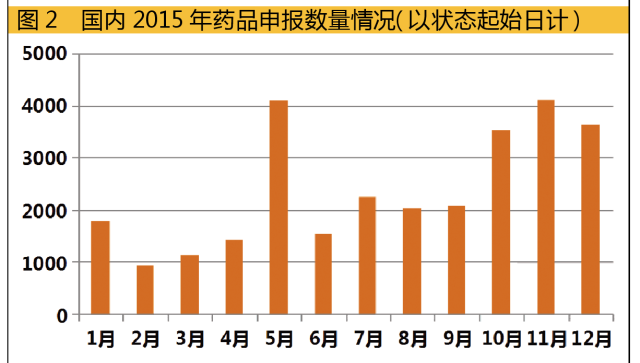
而在申报环节,虽然近期申报撤回消息不绝于耳,但国内药品整体申报量还是惊人。随着相关政策的不断深入,政策执行的结果或许在2016年有所显现。
欧洲: 未阻于经济低迷
2015年近百个药物获得批准上市,高于2014年的74个
虽然经历了经济低迷及难民潮的冲击,欧盟2015年批准人用药品数量高于2014年。截至2015年12月,欧盟共近百个药物获得批准上市,高于2014年的74个。一般而言,制药巨头出于对欧洲和美国等发达市场重视,获批新药大多会在两个市场同时上市。但由于有些制药巨头本身属于欧洲企业,出于企业考量,有些品种会先于美国上市。
大多数情况下,在美国上市的新药都会在欧盟上市。作为全球最大的医药市场,在美国先上市自然是企业的最佳选择,但也不乏将欧盟作为优先上市者,其原因各异。
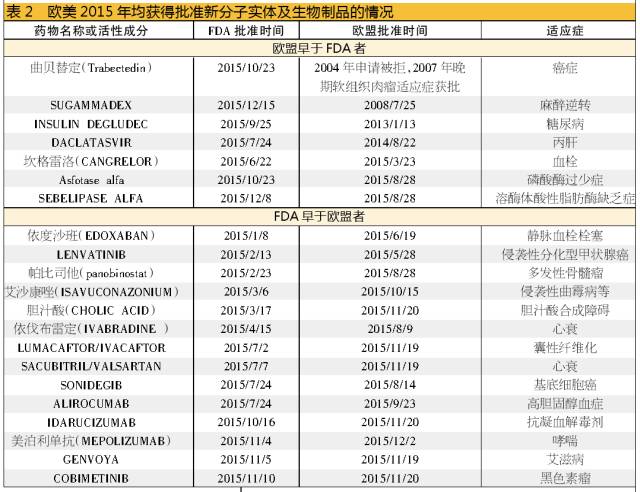
以西班牙生物技术公司PharmaMar开发的用于治疗转移性或晚期软组织肉瘤的药物曲贝替定(trabectedin)为例,2004年欧盟以其若干关键性临床试验的方法学存在问题为由拒绝批准,其后公司不得不增加数个临床试验数据再次申报,终于在2007年9月获得治疗晚期软组织肉瘤的许可。
2009年,该药向FDA提出申请,但因安全和疗效等原因遭拒;2014年,PharmaMar的美国战略合作伙伴Janssen Research & Development提交了新药上市申请,在提交最新临床Ⅲ期研究结果的情况下获得优先审核;2015年10月23日,FDA批准其用于治疗不可切除的或晚期脂肪肉瘤和平滑肌肉瘤。目前该药在77国家中均有销售。
从企业获得批文数量来看,2015年的最大赢家是诺华,拥有5个新药批文,其后是安进、默沙东和山德士等。但从数量来看,诺华获得批文数量少于2014年冠军强生的7个批文。
不得不提的还有日本企业的亮相,在2014年武田及大冢的药物获得欧盟批准后,2015年又有卫材、第一三共及大冢的药物上榜。
美国: TPO 10批文集度高
相较于批文分散于数千家企业的总体情况,占据前10的企业批文数之和,占到总批文数的24.2%
作为全球最大的创新原研药的动力源,美国每年都有为数众多的新分子实体和新生物制品获批。2015年,美国共有33个新分子实体和14个生物制品获得批准,高于2014年的30个新分子实体和11个生物制品。
其中有不少是有看点的全球首次获批的新药。如首个IL-17A单抗Cosentyx、首个anti-CD38单抗Darzalex、首个 IL-5单抗Nucala、首个“双下巴”溶脂针Kybella、首个溶瘤病毒疗法Imlygic等等,对未来的研发方向有着风向标的作用。特别是 PCSK9抑制剂全球首发市场的争夺,更是提前打响了他汀类之后未来降脂领域的重磅药物布局战。而首个治疗遗传性乳清酸尿症的药物Xuriden等的获批,标志着孤儿药研发进入持续发烧状态中。
近日美国众议院通过将给该国国立卫生研究院(NIH)拨出自2003年以来增长幅度最高的科研经费的草案,其中生物医药经费大幅增长,阿尔茨海默氏症研究经费提高了3.5亿美元,使NIH在该病研究领域的经费扩展到每年10亿美元。据阿尔茨海默氏症协会称,这是史上涨幅最高的一次。正是美国政府的持续大手笔的投入,使美国得以数十年屹立于全球医药研发的最前沿。
除去耗资不菲的创新药,作为全球最具活力的医药市场,每年企业送往FDA的药物审批文件也不在少数。2015年全年,FDA公布了3592 条审批信息。其中一季度853条审批信息,二季度875条,三季度最高977条,四季度887条。这些审批信息包括NDA(新药申请)2781条、 BLA(生物制品申请)117条、ANDA(简略新药申请)660条;全年共公布666条批准信息,128条临时性批准信息,其余为标签变更、补充临床数据等相关信息。
在这些新获批的批文中,与国内具有相似情形的是,出现最多批文的产品大多为输液或透析液类。
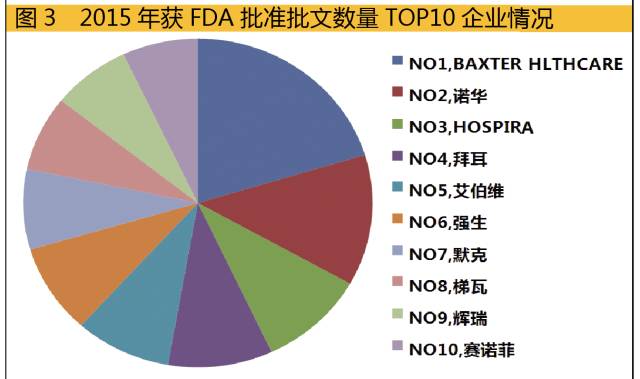
而在企业获得批文的数量方面,有2家公司获得的批文数超过百个,分别是BAXTER HLTHCARE以及诺华集团公司,有3家企业批文数超过70个,批文数在40~69个之间的有14家,在20~39个之间的有17家。占据前10的企业批文数之和,其数量占到总批文数的24.2%,相对于总体批文数分散于数千家企业之手而言,TOP 10企业的批文集中度可谓相当之高,而且这些企业也是全球超大型制药企业。
当然,在新获批文中也不乏印度雷迪博士、日本武田以及中国恒瑞等企业的身影。






加载更多