抗病毒类化学新药研发进展:治愈理想VS短药现实
抗病毒药物的研发至今仍是世界性的医学难题,能够通过药物治愈的病毒感染性疾病屈指可数,往往还要靠自身的免疫系统来清除。此外,抗病毒的新化合物经Ⅰ~Ⅲ期临床试验后,淘汰率高达70%以上,以致新的广谱抗病毒药物上市品种相对较少,像拉米夫定片这样有明确适应症的抗病毒药物依然奇缺。
与此相对的是各种病毒性疾病的发病率不断提高。世卫组织最新数据显示,2013年全球艾滋病感染者约为3500万人,新增感染者210万人。肝炎方面,全球有2.4亿多人患有慢性(长期)肝脏感染疾病,每年约有78万人死于急性或慢性乙型肝炎,有1.3亿~1.5亿人患有慢性丙肝感染,每年有35万~50万人死于与丙肝相关的肝脏疾病。流感病毒更是肆虐全球,仅季节性流感每年就要夺去全世界25万人的生命,而SARS、禽流感、甲流等病毒变异频繁。
CDE新药总览:低位徘徊
近五年,每年申请数不超过15个,受理号也不超过50个
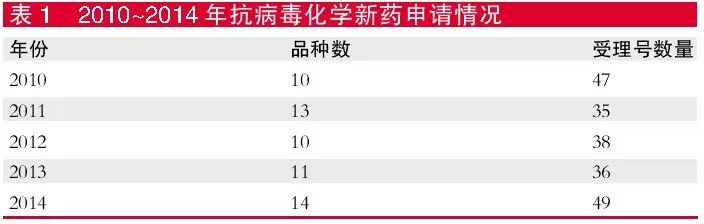
从CDE审评数据来看,近五年,CDE承办的抗病毒化学新药申请数量较为稳定,每年申请新药品种数未超过15个,受理号也未超过50个。2014年受理号只有49个,涉及品种14个。
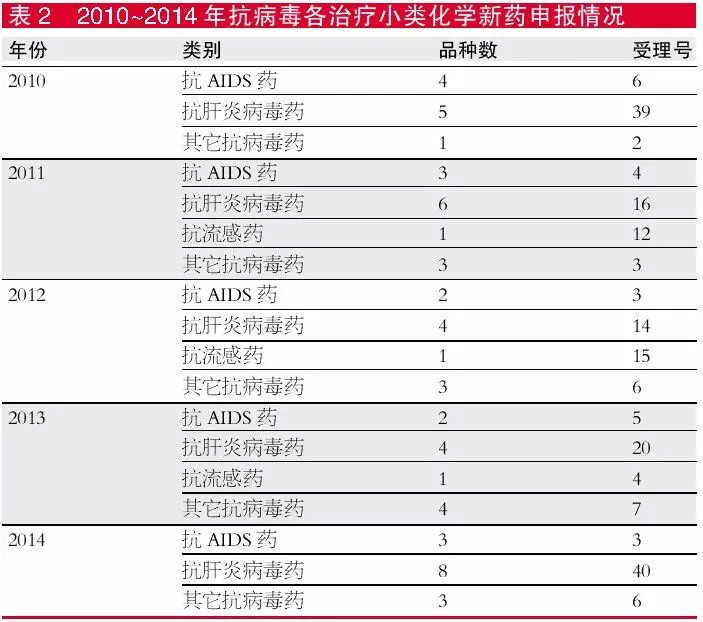
从治疗小类来看,近五年化学新药申请主要集中在抗肝炎病毒药上,2014年品种数最多,有7个,受理号数量38个。抗AIDS品种则徘徊在2~4个,受理号也在6个以下。抗流感品种在2011年开始每年只有1个品种,2014年则无相应新药品种申报。
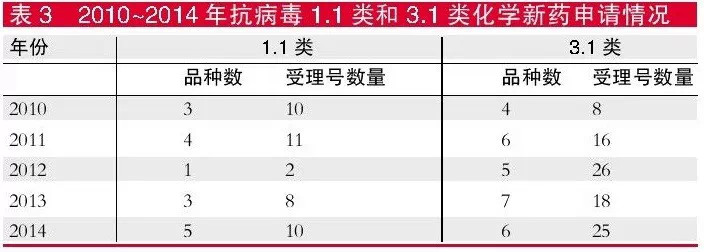
从注册类型来看,近五年抗病毒1.1类化学新药申请数量不多,品种在4个以下,受理号数量也未超出11个,3.1类新药申请同样较少,品种数在7个以下,但受理号则较多,从2010年的8个上升到2014年的25个。
抗AIDS药:2个1.1类
除了1.1类的艾夫他滨和阿兹夫定,3.1类的依非韦伦和3.2类的拉米夫定替诺福韦均为独家申报
2010~2014年,只有2个1.1类的抗AIDS化学新药申请,分别是2011年天津药物研究院申请的艾夫他滨及2013年郑州大学申请的阿兹夫定。阿兹夫定属世界领先、国内首创的新一代治疗艾滋病药物,目前处于国际领先的地位,它的活性比已上市的抗艾滋病药物(如:3TC等)要好得多,而毒性要小很多。

2014年申请的新药只有1个3.1类及2个3.2类品种且均为独家申报。其中3.1类新药依非韦伦为艾滋病一线用药,原研药为默克的施多宁,全球销售规模约8亿美元。3.2类新药拉米夫定替诺福韦片用于治疗艾滋病合并慢性病毒性乙型肝炎。拉米夫定和替诺福韦均属于核苷(酸)类抗反转录酶抑制剂,两者对人免疫缺陷病毒(HIV)和乙型肝炎病毒(HBV)都有抑制作用。由于患者对拉米夫定有较好的耐受性,所以拉米夫定成为治疗艾滋病合并慢性病毒性乙型肝炎患者的一线抗病毒药物物,但其有较高的耐药发生率。有研究表明,替诺福韦对HBV野毒株及拉米夫定耐药株都有较好的抑制作用。对于慢性乙型肝炎,联合用药可能会起到较好的抑制病毒作用并降低耐药率的发生,尤其是对合并感染HIV的患者。
抗肝炎药:11个1.1类
乙肝药聚焦阿德福韦酯、替诺福韦酯;丙肝药以NS3/4A抑制剂为主体,关注NS5A、NS5B抑制剂
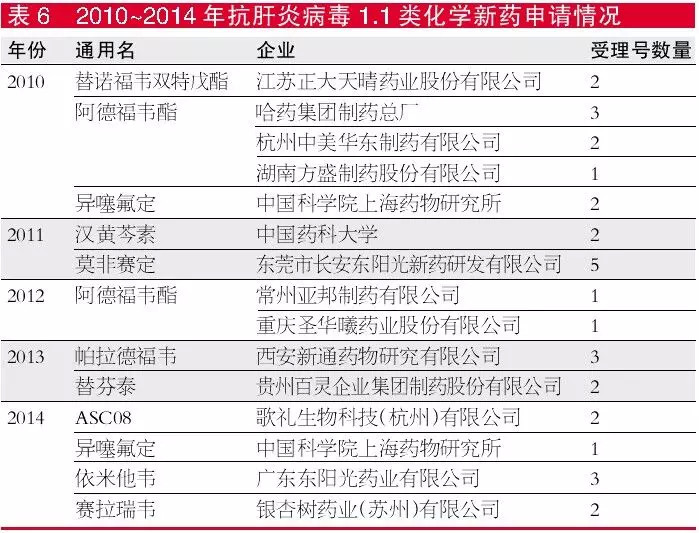
2010~2014年,有11个1.1类的抗肝炎病毒化学新药申请,其中阿德福韦酯在2010年及2012年共有5个厂家申报了1.1类新药。江苏正大天晴自主研发的阿德福韦酯(商品名:名正)在2006年获得生产批文并上市,是拥有自主知识产权的上市产品。阿德福韦酯用于治疗慢性乙型肝炎,尤其适合于需长期用药或已发生拉米夫定耐药者,因此成为厂家竞相开发的抗肝炎品种之一。
目前,慢性乙型肝炎是我国发病率最高的一种疾病,但由于国内许多病人家庭经济承受能力有限,难以承受昂贵的抗病毒药物,因此价格相对比较低的拉米夫定和阿德福韦酯依然占据相当比例的市场份额,国产优质优价的药品更是成为患者的重要选择。
替诺福韦酯是一种新型核苷酸类逆转录酶抑制剂,分别于2001年10月和2008年被美国FDA批准用于治疗艾滋病的和乙型肝炎(CHB)。包括中国在内的100多个国家已批准替诺福韦酯用于艾滋病的治疗,而美国等30多个国家和地区已获得了替诺福韦治疗乙型肝炎的适应症。替诺福韦是迄今抗乙肝病毒(HBV)活性最强、耐药屏障最高的核苷(酸)类药物,临床研究显示其对HBV、HBV合并HIV感染患者具有良好的抗病毒作用。2009年更新的AASLD(美国肝病研究学会)指南推荐将替诺福韦作为CHB抗病毒治疗的一线用药。2010年,替诺福韦获得治疗慢性乙型肝炎的中国新药临床试验,标志着替诺福韦这一慢性乙肝抗病毒治疗新药在中国的注册进入了新的阶段。
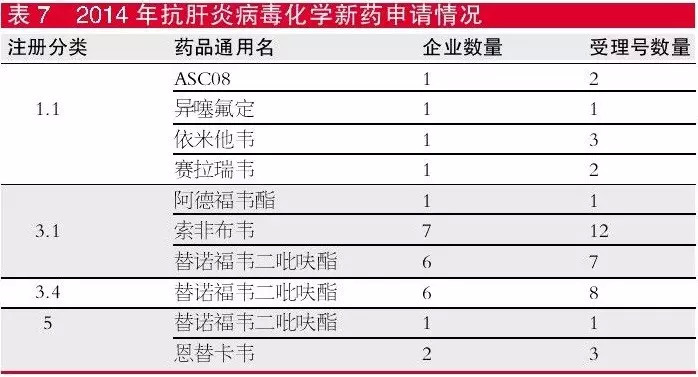
正大天晴最早申报了富马酸替诺福韦二吡呋酯的3.1+6类品种,然后申报了1.1类替诺福韦双特戊酯(改酯微创新品种)以及1.1类替诺福韦卡尼汀片(复方制剂)。2014年替诺福韦二吡呋酯有16个新药申请受理号,注册分类包括3.1类、3.4类和5类。
2014年申报的4个1.1类肝炎病毒新药中,除了异噻氟定是乙肝用药,其余3个均为丙肝用药。异噻氟定是由中科院上海药物所研制的非核苷类抗乙肝病毒新药,曾在2010年9月申报过异噻氟定及其胶囊剂的临床试验,并于2012年3月获得临床批准,此次申报的是其干混悬剂的临床试验。
国内目前自主研发的抗丙肝药物主要是NS3/4A蛋白酶抑制剂,包括苏州银杏树的赛拉瑞韦、杭州歌礼从Roche引进的danoprevir(ASC08)、正大天晴从BioLineRx引进的BL-8030。BL-8030是一种二代NS3蛋白酶抑制剂,目前仍处于临床前研究阶段,其余3个品种均在2014年申报了临床申请。
歌礼生物的丙肝新药ASC08临床研究结果表明,相较以基因1a型患者为主的高加索慢性丙肝人群,ASC08联合聚乙二醇干扰素α-2a和利巴韦林的治疗方案在以基因1b型患者为主的中国慢性丙肝人群中表现出了更高的治愈率。目前中国市场上还没有直接抗丙肝病毒药物,这一结果为中国丙肝患者提供全新的有效治疗方案迈出了一大步。
银杏树药业申报的赛拉瑞韦钾,2014年1月CDE承办,为特殊审批品种,2015年1月发补一次,经过短暂的2个月,现已进入审批阶段,预计会顺利批下临床。
广东东阳光申报的依米他韦则为NS5A抑制剂,是我国首个自主研发的NS5A抑制剂,适应症为丙肝,该药是重大专项品种,按特殊审批品种审评,2014年1月份申报,11月份就已获得临床批件,可谓相当迅速。(也有机构推测依米他韦是流感病毒NA抑制剂,与奥司他韦是一类药物,将其归为流感病毒类。)
2014年申报的3.1类新药索非布韦属于NS5B聚合酶抑制剂,也是丙肝治疗药。索非布韦于2013年12月6日经FDA批准在美国上市,2014年1月16日经EMEA批准在欧盟各国上市,目前还未在中国上市。该药堪称2013年FDA批准的最为重磅的药物。据分析人士预测,Gilead旗下以索非布韦为主力的丙肝业务在2014年销售额可达22亿美元,其中仅索非布韦便可占据17.3亿美元。Gilead乐观地估计,索非布韦一旦上市,其销售额最终有望冲破100亿美元。
丙肝是个日趋严重的公共卫生问题,这对于药企而言也意味着巨大的市场机遇。为了占领日渐扩大的丙肝药物市场,跨国药企正在争相开发更有效的新型口服药以取代干扰素,毕竟干扰素会产生一些严重的副作用,比如贫血、抑郁和流感样症状,而且每周注射一次的治疗方案也很难坚持。丙肝新药因其较目前的标准治疗方案有更高的病毒应答率而市场前景光明,而拥有这类型在研药物的企业也因此成为资本追逐的目标。我国已有企业在丙肝药物开发上迈出了步伐,未来将赢得市场先机。
抗流感药:仅1个1.1类
帕拉米韦成为“独苗”,2014年甚至没有新药申请,该类药物开发有待升温

2010~2014年,只有1个1.1类的抗流感化学新药品种申请,为帕拉米韦。2014年并没有抗流感新药申请,该类药物的开发有待升温。
帕拉米韦注射液研发历时8年,最早是由军事医学科学院在2007年10月提出临床申请,类别为化学1.1类,之后经历广州南新与军科院的合作以及湖南有色凯铂生物医药有限公司收购广州南新等变化,后两者于2011年12月提交的新药上市申请都是化学1.1类。帕拉米韦注射液在疗效上优于磷酸奥司他韦,能够有效对抗耐奥司他韦的流感病毒,且剂型为注射液,适应流感危重病人和对其他神经氨酸酶抑制剂疗效不佳患者的救治。2013年4月5日,帕拉米韦氯化钠注射液被CFDA加速批准上市。






