一、行业背景与市场现状
降脂药物行业近年来备受瞩目,主要由于高血脂症患者群体庞大,且心血管疾病(Cardiovascular Disease,CVD)特别是动脉粥样硬化(Atherosclerotic Cardiovascular Disease,ASCVD)已成为全球主要的死亡原因之一。根据世界卫生组织(WHO)数据,2019年,全球约有1790万人死于心血管疾病,占全球死亡总数的32%。其中,约85%的心血管疾病死亡是由心脏病发作和中风引起的[1-2]。而在国内,根据《中国心血管健康与疾病报告2022》报道,中国心血管疾病患病人数约为3.3亿,其中冠心病患者约1139万,心力衰竭患者约890万,脑卒中患者约1300万。心血管疾病是中国城乡居民的首位死亡原因,占死因构成在40%以上[3]。其中ASCVD在中国CVD中的占比约为70%-80%,与全球水平相近。具体到ASCVD的高危人群,如超高危患者中低密度脂蛋白胆固醇(LDL-C)长期达标率仅为30.1%。
我国目前的高血脂症治疗率较低,传统他汀类药物虽为降脂治疗的基础,但存在部分患者不耐受以及降LDL-C疗效不足等问题。此外,前蛋白转化酶枯草溶菌素9(PCSK9)单抗的长期依从性不佳,而降低脂蛋白(a)尚缺乏针对性疗法。因此,降脂领域仍存在较大的未被满足的需求,如何开发长效、高效且耐受性良好的新型降脂药物成为研发重点。
1、HMG-CoA还原酶(他汀类药物)
作用机制:HMG-CoA还原酶是胆固醇合成的限速酶,催化HMG-CoA转化为甲羟戊酸(MVA),这是胆固醇合成的关键步骤。他汀类药物通过与HMG-CoA竞争性结合酶的活性位点,阻断HMG-CoA的转化,从而抑制胆固醇合成。胆固醇合成减少会触发细胞内胆固醇稳态失衡,通过负反馈机制上调肝细胞表面低密度脂蛋白(LDL)受体的表达。增加的LDL受体加速血浆中LDL胆固醇的摄取和分解,从而降低血浆LDL-C水平。这一机制不仅能减少LDL-C,还能间接抑制极低密度脂蛋白(VLDL)的合成[4-5]。通过抑制胆固醇合成,他汀类药物减少VLDL中胆固醇的供应,导致VLDL合成减少及分解代谢增强,进而降低甘油三酯(TG)水平。此外,部分他汀类药物还能轻度提高高密度脂蛋白胆固醇(HDL-C)水平,进一步优化血脂谱。
临床应用:包括阿托伐他汀、匹伐他汀等,可降低TC、LDL-C水平,但长期使用可能导致代偿性HMG-CoA还原酶活性升高。
2、NPC1L1(依折麦布)
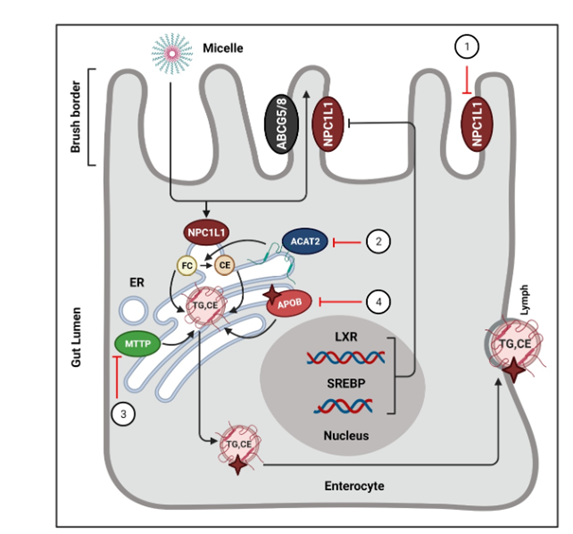
作用机制:小肠黏膜刷状缘的NPC1L1蛋白(Niemann-Pick C1-Like 1)是介导肠道胆固醇吸收的关键转运蛋白,负责将饮食来源的外源性胆固醇和胆道重吸收的内源性胆固醇转运至肠上皮细胞。依折麦布是首个NPC1L1抑制剂,通过与NPC1L1胞外区C环第61位氨基酸结合,阻断其构象变化,抑制Y1306VNxxF结构域解离及NUMB蛋白的招募,从而阻碍胆固醇的跨膜转运。同时干扰NPC1L1与Flotillin-1/-2形成的胆固醇富集膜微域,减少胆固醇在肠道的吸收[6]。
临床应用:依折麦布可单独使用或与他汀类联用,进一步降低LDL-C水平,减少心血管事件。
(3)ACL(贝派地酸)
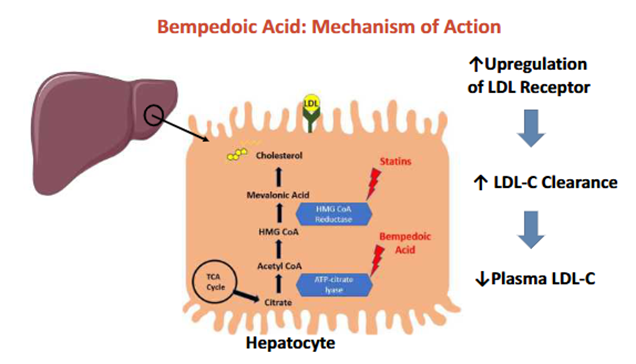
作用机制:ACL是胆固醇合成途径中的关键酶,位于HMG-CoA还原酶(他汀类药物的靶点)上游。ACL催化柠檬酸裂解为乙酰辅酶A(Acetyl-CoA)和草酰乙酸(OAA),而Acetyl-CoA是胆固醇和脂肪酸合成的初始原料。贝派地酸作为前药,需在肝脏中被超长链酰基辅酶A合成酶1(ACSVL1)激活为ETC-1002-CoA,进而抑制ACL活性,减少Acetyl-CoA生成,从而阻断胆固醇的合成。ACL抑制后,肝细胞内胆固醇水平下降,通过负反馈机制上调低密度脂蛋白受体(LDL-R)的表达,增强对血浆LDL-C的摄取和清除。贝派地酸仅在肝脏被激活,避免在骨骼肌代谢,从而降低肌痛等副作用。
临床应用:贝派地酸已在美国获批用于家族性高胆固醇血症,但国内尚未上市。
PCSK9靶点作为降脂领域的成熟靶点,近年来研发进展迅速。PCSK9由肝脏产生,与LDL-R结合后导致受体降解,减少肝脏对LDL的摄取,造成血浆中的LDL-C水平升高。部分单克隆抗体抑制剂利用这一机制,通过靶向循环系统中的PCSK9蛋白,阻止其与LDL-R结合,恢复LDL-R功能,增强对LDL的清除。另一种思路是通过RNA干扰技术(siRNA)特异性降解PCSK9的mRNA,减少其转录与蛋白水平的合成,从源头降低肝脏中PCSK9的产生,作用更为持久[8]。
临床应用方面,截至目前世界范围内已有六款单克隆抗体产品已获批上市。
诸多产品的临床数据均已证明了PCSK9作为靶点用于高胆固醇血症,尤其是他汀不耐受或他汀治疗效果不佳的患者的有效性与安全性。笔者汇总了这六款单抗的重要临床数据、给药方式以及用药费用等信息,供读者参考。
FOURIER研究(NCT01765670):主要评估伊洛尤单抗在降低心血管事件中的作用。与安慰剂相比,伊洛尤单抗显著降低了主要心血管事件(包括心肌梗死、中风等)的发生率,相对风险降低15%。
MENDEL-2研究(NCT01663805):主要评估伊洛尤单抗在降低LDL-C水平中的作用。伊洛尤单抗显著降低LDL-C水平,平均降幅达59%。
ODYSSEY OUTCOMES研究(NCT01938871):评估阿利西尤单抗在降低心血管事件中的作用。阿利西尤单抗显著降低了主要心血管事件的发生率,相对风险降低15%。
ODYSSEY COMBO I研究(NCT01663418):评估阿利西尤单抗在降低LDL-C水平中的作用。阿利西尤单抗显著降低LDL-C水平,平均降幅达56%。
TULIP研究(NCT02228668):评估托莱西单抗在降低LDL-C水平中的作用。托莱西单抗显著降低LDL-C水平,平均降幅达50%。
ORION-11研究(NCT03400085):伊努西单抗显著降低LDL-C水平,平均降幅达52%。
ONGO-1研究(NCT04458465):评估昂戈瑞西单抗在降低LDL-C水平中的作用。昂戈瑞西单抗显著降低LDL-C水平,平均降幅达55%。
RECA-1研究(NCT03827615):瑞卡西单抗显著降低LDL-C水平,平均降幅达54%。
小结:综合考虑,伊洛尤单抗和阿利西尤单抗的给药周期较为灵活,可选择每2周或每月一次;伊努西单抗的给药周期最长,每6个月一次,适合需要长期治疗的患者。各款药物在降低LDL-C水平方面均表现出显著效果,平均降幅在50%-60%之间。伊洛尤单抗和阿利西尤单抗在心血管事件风险降低方面也有显著效果。对于需要频繁给药的患者,可选择托莱西单抗或瑞卡西单抗;对于需要长期稳定治疗的患者,伊努西单抗可能是更好的选择;对于关注心血管事件风险的患者,伊洛尤单抗和阿利西尤单抗是较好的选择。
推至临床的PCSK9竞品,产品类型更加多元化,增加了如融合蛋白、重组蛋白、基因/碱基编辑的产品。另外还有13款产品处于临床前阶段(篇幅原因未展示)。
除靶向PCSK9的单抗药物外,其他新类型产品也如雨后春笋般的出现。其中最有代表性的为Inclisiran(商品名:Leqvio,乐可为)是首个获批上市的靶向PCSK9的长效siRNA药物。它是一种双链小干扰RNA(siRNA),主要作用机理为通过特异性结合PCSK9 mRNA,触发RNA诱导沉默复合体(RISC)的活性,从而降解PCSK9 mRNA,减少肝脏中PCSK9蛋白的表达。ORION-9、ORION-10和ORION-11等临床试验均证实了Inclisiran Sodium在降低LDL-C方面的显著效果。例如,在ORION-11试验中,患者在使用Inclisiran Sodium治疗后,LDL-C水平在第510天时平均降低了52.3%。在ORION-3的长期扩展研究中,患者接受Inclisiran Sodium治疗长达4年,结果显示其长期安全性良好。Inclisiran钠采用GalNAc偶联技术,使其能够高效靶向肝细胞。这种递送方式不仅提高了药物的稳定性和生物利用度,还减少了对其他组织的潜在毒性。此外,Inclisiran具有长效特性,通常每六个月注射一次即可维持降脂效果。目前全球仅有一款siRNA药物上市。其他多个靶向PCSK9的siRNA药物处于研发早期,包括Rona Therapeutics的RN0191,I期临床试验显示出良好的安全性和超过85%的PCSK9最大降低和超过55%的LDL-C降低。
2、Apo(a)/Lp(a)靶点
Apolipoprotein(a),简写为Apo(a),能通过与低密度脂蛋白(LDL)结合形成脂蛋白(a)(Lp(a)),其血浆浓度与动脉粥样硬化性心血管疾病(ASCVD)风险显著相关。Apo(a)的合成由LPA基因编码,遗传因素主导其表达水平,并不受饮食与生活方式影响。当前降脂策略主要通过抑制Apo(a)合成实现,通过调节脂蛋白颗粒组成,降低血液中致动脉粥样硬化脂质的载运能力。
注:anti-Lp(a)作用机制[8]
 目前布局在靶向Lp(a)的产品全球范围内为上图所示的5个,均为小分子药物,暂无单克隆抗体药物。笔者将这几款产品的临床数据情况及疗效汇总至表格,供读者参考。
作用机制:礼来公司开发的口服小分子药物,通过Lp(a)与ApoB-100的结合,抑制Lp(a)的形成。
临床试验(NCT05416668):主要终点考察从基线到第12周Lp(a)水平的变化百分比。次要终点考察12周内Lp(a)水平降低至125 nM以下的患者比例及LDL-C水平变化。Ⅱ期临床试验显示,12周后,每日一次240 mg的Muvalaplin可使Lp(a)水平降低85.8%。
作用机制:siRNA技术降解Apo(a)mRNA干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第36周Lp(a)水平的变化百分比。次要终点考察LDL-C水平变化;治疗结束半年内Lp(a)水平的持续性。Ⅱ期临床试验中,以450 mg、每24周两次的给药方式治疗36周后,可使Lp(a)水平降低85.6%。
作用机制:安进公司开发,siRNA技术降解Apo(a)mRNA干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第12周Lp(a)水平的变化百分比。
次要终点考察LDL-C水平变化。Ⅱ期临床试验已完成结果显示可显著降低Lp(a)水平,降低幅度高达70%-100%。
作用机制:siRNA技术降解Apo(a)基因编码的LHA序列,干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第12周Lp(a)水平的变化百分比。
次要终点考察LDL-C水平变化。单次注射后,血清Lp(a)水平在第337天下降94%,最高降幅达97%。目前处于Ⅲ期临床阶段。
作用机制:由诺华开发,通过反义寡核苷酸(ASO)技术,靶向LPA的mRNA诱导降解,从而抑制Apo(a)及Lp(a)的生成。
临床试验(NCT05248270):Ⅱ期临床试验已完成,可显著降低Lp(a)水平,降幅至80%,目前处于Ⅲ期临床。
小结:化药类药物和抗体类药物在降脂领域各有优缺点。化药类药物具有口服便利性和价格优势,但部分药物可能需要更频繁的给药和监测潜在副作用。抗体类药物则具有高效降脂和长效作用的优势,但给药方式相对不便且价格较高。选择哪种药物应根据患者的具体情况和需求来决定。
目前布局在靶向Lp(a)的产品全球范围内为上图所示的5个,均为小分子药物,暂无单克隆抗体药物。笔者将这几款产品的临床数据情况及疗效汇总至表格,供读者参考。
作用机制:礼来公司开发的口服小分子药物,通过Lp(a)与ApoB-100的结合,抑制Lp(a)的形成。
临床试验(NCT05416668):主要终点考察从基线到第12周Lp(a)水平的变化百分比。次要终点考察12周内Lp(a)水平降低至125 nM以下的患者比例及LDL-C水平变化。Ⅱ期临床试验显示,12周后,每日一次240 mg的Muvalaplin可使Lp(a)水平降低85.8%。
作用机制:siRNA技术降解Apo(a)mRNA干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第36周Lp(a)水平的变化百分比。次要终点考察LDL-C水平变化;治疗结束半年内Lp(a)水平的持续性。Ⅱ期临床试验中,以450 mg、每24周两次的给药方式治疗36周后,可使Lp(a)水平降低85.6%。
作用机制:安进公司开发,siRNA技术降解Apo(a)mRNA干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第12周Lp(a)水平的变化百分比。
次要终点考察LDL-C水平变化。Ⅱ期临床试验已完成结果显示可显著降低Lp(a)水平,降低幅度高达70%-100%。
作用机制:siRNA技术降解Apo(a)基因编码的LHA序列,干扰Lp(a)的合成。
临床试验(NCT05248270):主要终点考察从基线到第12周Lp(a)水平的变化百分比。
次要终点考察LDL-C水平变化。单次注射后,血清Lp(a)水平在第337天下降94%,最高降幅达97%。目前处于Ⅲ期临床阶段。
作用机制:由诺华开发,通过反义寡核苷酸(ASO)技术,靶向LPA的mRNA诱导降解,从而抑制Apo(a)及Lp(a)的生成。
临床试验(NCT05248270):Ⅱ期临床试验已完成,可显著降低Lp(a)水平,降幅至80%,目前处于Ⅲ期临床。
小结:化药类药物和抗体类药物在降脂领域各有优缺点。化药类药物具有口服便利性和价格优势,但部分药物可能需要更频繁的给药和监测潜在副作用。抗体类药物则具有高效降脂和长效作用的优势,但给药方式相对不便且价格较高。选择哪种药物应根据患者的具体情况和需求来决定。
3、其他靶点
除了PCSK9和Lp(a),降脂领域还有多个其他靶点正在积极研发中,包括CETP、APOC3和ANGPTL3等。
三、2024年降脂药物市场相关情况
2024年降脂药物销售额在不同国家与地区的表现有所区别。以美国为例,北美地区是全球降脂药市场的主要消费地区之一。2024年美国的降脂药市场规模预计超过200亿美元。作为降脂药物的主流,他汀类药物在美国市场占据重要地位。根据相关数据,2023年上半年,他汀类药物的销售额达到100.3亿元人民币(约合14.7亿美元),占心血管用药市场的68%。PCSK9抑制剂紧随其后,2023年上半年销售额为15.25亿元人民币(约合2.1亿美元),占心血管用药市场的10.4%。以诺华的超长效降脂药物乐可为(Leqvio)为例,2024年全球销售额同比增长114%,达到7.54亿美元。
中国的降脂药市场规模在2024年预计达到230亿元人民币,同比下降3.9%。其中阿托伐他汀长期占据国内院端降脂药销售榜首,2024年上半年销售额达12亿元人民币;2024年上半年,PCSK9抑制剂的销售额达12.88亿元人民币,同比增长85.23%。乐可为2024年的国内销售额达到了5.31亿美元,同比增长超过100%。
小结:以他汀类药物为主导的局面仍将持续一段时间,但随着PCSK9抑制剂和新型降脂药物的不断推广与应用,其市场份额有望进一步扩大。特别是像乐可为这类具有独特优势的新型降脂药物,凭借其长效性和良好的安全性,正在逐渐改变市场格局,未来有望在降脂治疗中占据更重要的地位。在医保政策的推动下,一些新型降脂药物的可及性得到了提高,为患者带来了更多的治疗选择。同时,随着国内医药研发水平的提升,一些本土创新的降脂药物也逐渐崭露头角,有望在未来几年内为市场注入新的活力。不过,由于市场竞争激烈,仿制药的大量涌入也使得整体市场增速有所放缓,但结构优化的趋势明显,未来市场将更加注重药物的创新性和临床价值。
四、结论
降脂药物行业在庞大的患者群体和未被满足的临床需求推动下,正迎来快速发展期。PCSK9、Lp(a)、CETP、APOC3和ANGPTL3等靶点的研发进展显著,新技术路线不断涌现,为患者提供了更多治疗选择。随着创新药物的不断推出以及政策支持的加强,降脂药物将更加注重个性化与精准化治疗,市场将迎来更广阔的发展前景。未来,随着对血脂代谢机制的深入研究和新技术的不断应用,降脂药物的研发有望取得更多突破,为心血管疾病的防治做出更大的贡献。
五、参考资料
1、World Health Organization. Cardiovascular diseases (CVDs).
https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds)
2、Global Burden of Disease Collaborative Network. Global Burden of Disease Study 2019 (GBD 2019) Results. Institute for Health Metrics and Evaluation (IHME), 2020.
3、中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2022概要. 中国循环杂志, 2022。
4、Statins in the Prevention and Treatment of Primary Liver Cancers: From Molecular Mechanisms to Clinical Perspectives. Cancers, 15(2), 5100.
5、Lipid composition of the cancer cell membrane. J Bioenerg Biomembr 52, 321–342 (2020).
6、Recent Molecular Mechanisms and Beneficial Effects of Phytochemicals and Plant-Based Whole Foods in Reducing LDL-C and Preventing Cardiovascular Disease. Antioxidants, 10(5), 784.
7、Drug Design, Development and Therapy. 2021;15:1955-1963.
8、Novel and future lipid-modulating therapies for the prevention of cardiovascular disease. Nat Rev Cardiol. 2023 Sep;20(9):600-616.

























评论
加载更多