一文了解基因治疗和基因编辑技术行业发展和监管要点

我国基因治疗、基因编辑技术近几年发展迅速,甚至成为生物科技企业的主要发展方向之一。为助力各新兴及成熟基因治疗及基因编辑技术企业更为准确地把握对应监管尺度及合规要求,减少违规风险,我们特此先对基因治疗与基因编辑技术的定义进行厘清。
美国FDA(Food and Drug Administration)生物制品评价与研究中心(Center for Biologics Evaluation and Research,“CBER”)于1998年发布的《行业指南:人类体细胞治疗和基因治疗指南》(Guidance for Industry: Guidance for Human Somatic Cell Therapy and Gene Therapy)中,将基因治疗定义为一种基于修饰活细胞遗传物质而进行的医学干预,细胞可以在体外被修饰,随后再注入患者体内,或可以通过在患者体内直接注入基因治疗产品,使得细胞内发生遗传学改变[1]。
与美国类似,在我国,基因治疗于1993年被原卫生部在《人的体细胞治疗及基因治疗临床研究质控要点》中定义为改变人活细胞遗传物质的一种医学治疗方法(a medical intervention based on modification of genetic materials of living cells),且将基因治疗按其基因导入人体途径分为两大类:一种是Ex vivo将人体细胞,经体外导入外源基因后再用于人体;另一种是体内(In vivo)将含外源基因的重组病毒在保证不存在复制型病毒(Replication competent virus)的前提下,直接用于人体。另外,也已有用含外源基因的重组DNA本身或与人工载体。脂质体或其它介导物质形成复合物后导入人体。以上基因操作用于治疗,也可用于预防的目的[2]。
有别于基因治疗,基因编辑技术是指用可编辑的核酸酶识别基因组特定位点并介导DNA双链断裂(double-strand breaks, DBS),随后诱发内源性DNA修复机制,从而实现对DNA序列的定点修饰的技术,包括靶向敲除或插入基因[3]。目前[4],基因编辑的相关技术主要包括以下3个细分技术[5]:
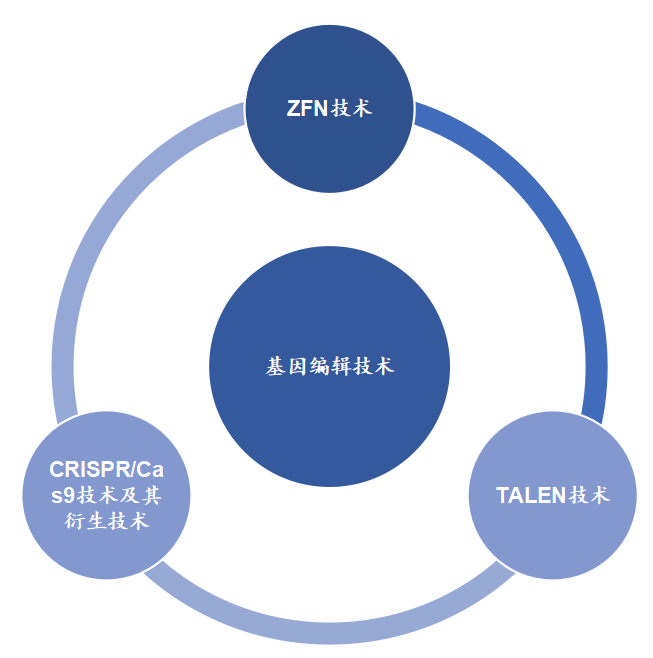
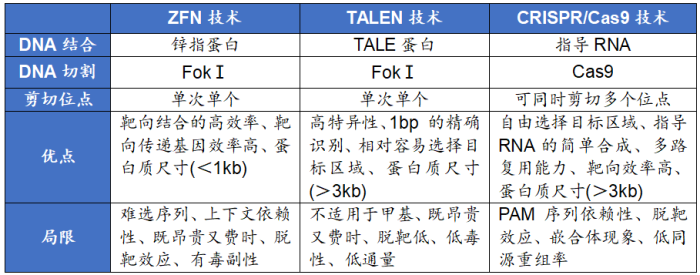
据有关报告总结显示,上述ZFN技术、TALEN技术、CRISPR/Cas9技术在DNA结合、DNA切割、剪切位点、优点、局限等维度存在一定的差异性,具体为[6]:
除前述较为热门、主流的基因编辑技术外,目前我国部分生物科技企业也在积极投身新一代基因编辑技术“碱基编辑技术”的相关产品研发,如正序生物、新芽基因等。碱基编辑技术主要通过“效应器”和“定位器”相结合,在靶向位点完成碱基转换,从而实现基因组编辑和改写,在完全保证DNA双链完整性的同时,可对错误的碱基进行校正。因此,碱基编辑技术不会促发染色体异常等安全风险,一定程度上可以确保编辑的高效性和安全性[7]。

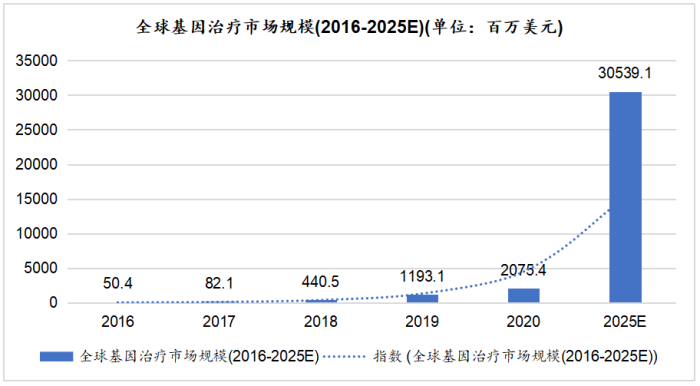
就基因治疗而言,自2015年以来,全球基因治疗行业开始进入高速发展期。从2016年到2020年,全球基因治疗市场规模从5,040万美元增长至20.8亿美元,预计到2025年,全球基因治疗市场规模将达到近305.4亿美元。
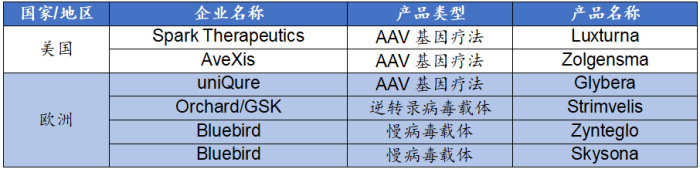
据统计,从2012年至2021年,美国 FDA共批准2款基因治疗产品,均为AAV基因疗法。[9]除前述两款产品外,欧洲药品管理局(EMA)批准了其他4款基因治疗产品。各产品具体情况如下:
就基因编辑技术而言,全球研发管线主要集中于CRISPR/Cas9技术。目前,国外基因编辑产品管线的主要情况如下[10]:
就基因治疗而言,根据弗若斯特沙利文统计的有关数据及预测,2020年我国基因治疗市场规模仅为2380万元,随着国内产业相关利好政策的不断出台以及基因治疗产品临床试验的广泛开展,至2024年、2025年我国基因治疗市场规模预计分别达成85.18亿元人民币、178.85亿元人民币[11]。
目前,国内在研基因疗法产品多处于临床阶段,其中,产品类型大多为AAV载体,部分代表企业和典型产品情况如下[12]:
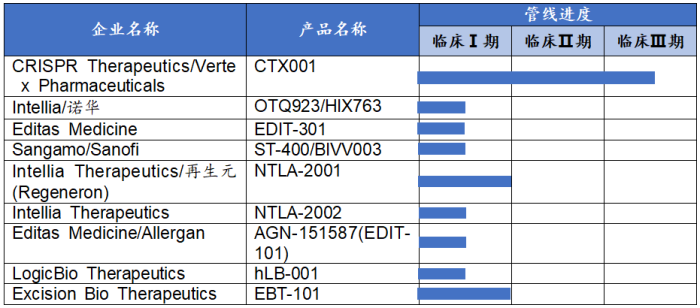
就基因编辑技术而言,不同于基因治疗产品管线的研发进度,国内基因编辑管线产品整体仍处于临床早期阶段,部分代表企业和产品管线进度等如下表所示[13]:
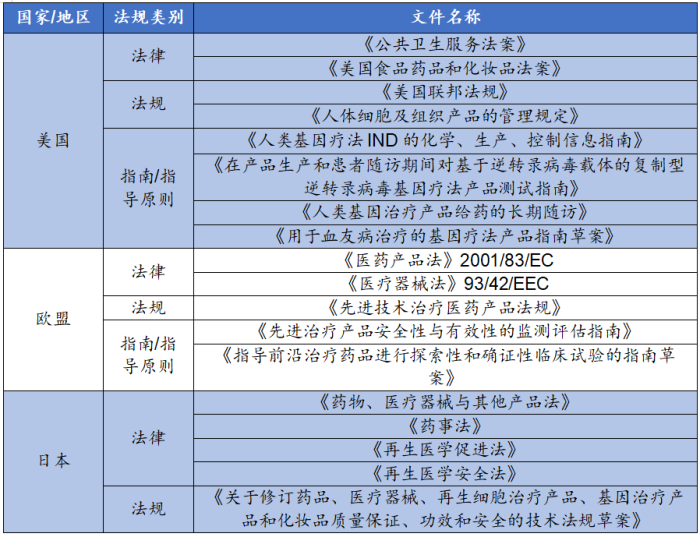
美国、欧盟等国家及地区针对基因治疗、基因编辑技术制定了多项法律文件予以规制,包括但不限于法律、法规、指南/指导原则等,这些法律文件构成了各国(地区)自上而下的、统一的监管体系(部分如下表所示),为国(地区)内基因治疗、基因编辑技术企业机构提供合规参考依据,也有助于其在法律规定的范围之内,加快相关产品的研发与上市,促进基因治疗、基因编辑技术行业的整体规范向前发展。
在我国,基因治疗、基因编辑技术如以药品注册上市为目的开展各项研究和商业化活动,不仅受到《药品管理法(2019修订)》等一般药品法律的规制,还需遵守相应领域单行法律规范性文件的监管要求,包括但不限于《人基因治疗研究和制剂质量控制技术指导原则》《体内基因治疗产品药学研究与评价技术指导原则(试行)》《体外基因修饰系统药学研究与评价技术指导原则(试行)》等,下图就部分重要法律文件进行列举展示。

特别地,鉴于基因编辑技术的特殊性与风险性,《民法典》及《刑法(2020修正)》对相关研发活动予以了特别限制,包括:(1)从事与人体基因、人体胚胎等有关的医学和科研活动的,应遵守法律、行政法规和国家有关规定,不得危害人体健康,不得违背伦理道德,不得损害公共利益[14];以及(2)将基因编辑、克隆的人类胚胎植入人体或者动物体内,或将基因编辑、克隆的动物胚胎植入人体内,情节严重的,构成非法植入基因编辑、克隆胚胎罪[15]。
首先,《外商投资准入特别管理措施(负面清单)(2021年版)》于2022年1月1日正式实施,其中,第19条规定,禁止投资人体干细胞、基因诊断与治疗技术开发和应用。
值得注意的是,截至目前,我国尚无法律法规对“基因诊断与治疗技术”的含义及范围予以明确,且相应监管机关也暂未发布有关官方文件对此予以释明。由此,实践中,多数企业对于“基因诊断与治疗技术”范围的判断与把握存在一定难度。基于以往的法律服务经验,我们倾向于认为,根据文义解释,本文所述基因编辑技术不排除落在此禁止投资范围之内,但鉴于目前尚无相关民事判决、行政监管或处罚案例对应进行判定,因此,仍有待未来国家出台具体法律法规对此加以确定。
其次,在商务部2022年12月30日发布的《关于<中国禁止出口限制出口技术目录>修订公开征求意见的通知》(“《征求意见稿》”)中,提出拟新增7项技术条目,其中包括用于人的细胞克隆和基因编辑技术及CRISPR基因编辑技术。《征求意见稿》虽尚不具有法律约束力,但在一定程度上反映了我国对于基因编辑技术的监管尺度渐严,具体而言,在《征求意见稿》中:
最后,值得注意的是,据商务部服贸司负责人的答复[16],技术出口分为自由、限制和禁止三类。其中,限制类技术进出口需要申请对应技术出口许可证,否则可能影响技术出口合同的最终效力,进而最终影响相关企业机构的跨境业务开展。技术出口许可证的申办具体流程如下:
此外,由于技术出口合同的批准手续影响合同生效,对于负有办理批准手续义务的一方而言,若其未履行申请批准等手续或发生违反约定情形的,将可能存在依照《民法典》第502条承担相应民事责任的风险。
1)临床前研究动物种属监管要求
基因治疗产品作用机制特殊且多样,起效方式复杂,非临床试验设计、实施以及研究设计中试验类型、时间安排和灵活性,可能与其它药物的非临床研究存在不同。为此,国家药监局药品审评中心(“CDE”)于2021年2月9日发布《基因治疗产品非临床研究与评价技术指导原则(试行)》(“《指导原则》”),《指导原则》提出:在适当情况下,基因治疗产品研发中应考虑其他非临床研究指导原则的建议,如用于支持基因治疗产品研发的非临床安全性研究应遵循《药物非临床研究质量管理规范》(GLP),而基因治疗产品研发与其他指导原则的非临床试验建议不一致的特殊情况下,适用本《指导原则》[17]。
其中,不同于以患者为对象的临床试验,主要为临床试验提供支持性信息的基因治疗产品非临床研究应在相关动物种属中开展,《指导原则》明确可选择野生型、免疫缺陷型、人源化或其它基因修饰的动物。某些情况下可以采用非常规的动物种属和品系开展非临床试验,如基因修饰啮齿类动物(例如转基因或基因敲除)、其它啮齿类动物(例如叙利亚仓鼠、棉鼠等)、以及非啮齿类动物(例如绵羊、猪、山羊、马等)。但采用前述非常规的动物种属和品系需提供对应的科学依据。[18]
2)临床前研究其他特殊性要求
除前述动物种属监管要求外,鉴于基因治疗产品具有生物学复杂性、作用具有持续性等,《指导原则》在药理学、药代动力学、毒理学、首次临床试验起始剂量、关键非临床研究等方面均规定了相应特殊性要求,如:(1)由于种属和免疫状态的差异,基因治疗产品在人体内的表达、分布和作用与在模型动物中可能有较大不同,可选用替代产品(如治疗基因使用来自模型动物的同源基因,或使用基因修饰的模型动物细胞、组织和类器官等)进行POC研究等;(2)基因治疗产品生物分布研究应采用足够的剂量,以临床拟用的给药途径,在相关动物种属或动物模型中开展,不仅包括导入基因的检测,还可能包括导入基因表达产物、载体的检测。采样时间点的安排应能体现基因治疗产品体内过程的特点,至少包括在靶组织和非靶组织的峰值和稳态阶段等。
1)伦理委员会审查要求
2018年12月,我国南方科技大学原副教授贺某对外宣布“基因编辑婴儿”诞生。经有关机关查明,涉事科研人员贺某自2017年3月至2018年11月伪造伦理审查书,招募8对夫妇(男方患有艾滋病,女方未患病)作为志愿者孕育胚胎,在人类胚胎上进行基因编辑并植入母体。2019年12月30日,深圳市南山区人民法院一审公开宣判,认定贺某等三人构成非法行医罪,根据犯罪事实、性质、情节和对社会的危害程度,分别依法判处被告人贺某、张某、覃某有期徒刑3年、2年、1年6个月(缓刑2年),并处罚金人民币300万元、100万元、50万元[19]。
此案之后,国家进一步将强了科技伦理审查的监管要求,包括(1)自2021年10月1日起试行的《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》(“《IIT试行管理办法》”)规定,所有临床研究均应通过科学性审查和伦理审查[20];且(2)中共中央办公厅联合国务院办公厅于2022年3月20日发布的《关于加强科技伦理治理的意见》也提出,从事生命科学、医学、人工智能等科技活动的单位,研究内容涉及科技伦理敏感领域的,应设立科技伦理(审查)委员会。
如有关企业/机构或人员违规开展基因编辑技术研究,存在将基因编辑、克隆的人类胚胎植入人体或者动物体内,或将基因编辑、克隆的动物胚胎植入人体内,情节严重的,将可能被处以3年以下有期徒刑或拘役,并处罚金;情节特别严重的,将可能处3-7年有期徒刑,并处罚金[21]。
2)其他基因编辑技术临床研究开展要求
除前述有关伦理审查合规要求外,根据《IIT试行管理办法》的相关规定,临床研究过程中,医疗机构及其研究者要充分尊重研究对象的知情权与自主选择权。同时,严禁违规向受试者或研究对象收取与研究相关的费用。
特别地,在国家卫健委2019年2月26日发布的《生物医学新技术临床应用管理条例(征求意见稿)》中,将基因编辑技术等涉及遗传物质改变或调控遗传物质表达的技术列为高风险生物医学新技术,此类临床研究由国务院卫生主管部门(即卫健委)管理[22]。《IIT试行管理办法》对此也明确规定,临床研究的有关信息应在国家医学研究登记备案信息系统按要求完成上传,完成登记的临床研究有关信息,通过系统或国家卫健委明确的平台向社会公开,接受同行和社会监督[23]。
值得注意的是,如相关企业或机构在开展基因编辑技术临床研究过程中,存在未保障受试者知情同意等权益,违规向受试者收取费用以及未依法进行相应研究项目备案等情形的,不排除面临承担(1)被要求立即改正;(2)停止违规开展的研究、妥善保护受试者权益;(3)被相关卫生健康行政部门依法处理;(4)构成犯罪的,移交司法机关依法处理等相应法律后果的风险[24]。
此外,如受试者相关权益受到了侵害,相关企业机构可能还将面临相关民事索赔争议纠纷等相关法律问题。
1)长期随访监管要求
基因治疗临床试验除需遵守一般药物临床试验的管理规范外,基于其自身技术特点,还需额外遵守特殊的对应监管要求。如基因治疗通过引起人体的永久或长期的变化达到治疗效果,这些变化在人体内长期存在,因此,可能增加不可预测的风险如迟发性不良反应等。为了评估和降低迟发性不良反应等风险,并了解治疗效果随时间延长的变化,有必要对接受基因治疗临床试验的受试者开展长期随访。为此,CDE于2021年12月正式发布《基因治疗产品长期随访临床研究技术指导原则(试行)》。其中,针对不同类型的基因治疗产品,CDE建议确保如下观察时间:
2)临床试验其他监管要求
此外,根据《人基因治疗研究和制剂质量控制技术指导原则》的有关规定,在向国家药监局申报基因治疗临床试验时,除须准备“研究内容和制品质量控制”材料外,还需提供国内外研究现状和进展(综述)与本研究或制品的知识产权情况等,以方便CDE更好地了解申报过程中基因治疗药物在国际范围内的临床技术价值。
值得注意的是,如相关企业机构在开展基因治疗产品临床试验过程中,未满足上述监管要点及相关技术指导原则的其他相关要求,根据《药品管理法(2019修订)》《药品注册管理办法(2020)》以及《药物临床试验质量管理规范(2020修订)》等法律法规及规范性文件的有关规定,不排除存在被处以“责令限期改正,给予警告,罚款,责令停产停业整顿直至吊销药品批准证明文件”等相关行政处罚的风险。
1)临床试验数据的合规性和真实性要求
原国家食药监局于2015年7月22日发布《关于开展药物临床试验数据自查核查工作的公告》提出:所有已申报并在总局待审的药品注册申请人,均须按照《药物临床试验质量管理规范》等相关要求,对照临床试验方案,对已申报生产或进口的待审药品注册申请药物临床试验情况开展自查,确保临床试验数据真实、可靠,相关证据保存完整。其后,原国家食药监局进一步发布《关于药物临床试验数据核查有关问题处理意见的公告》,对药品注册申请人、研究者、药物临床试验机构和合同研究组织(“CRO”)的临床数据合规性和真实性责任划分如下:

根据《药品管理法(2019修订)》与《最高人民法院、最高人民检察院关于办理危害药品安全刑事案件适用法律若干问题的解释(2022)》的有关规定,若相关主体违反临床试验等数据合规性和真实性要求,可能面临如下行政责任乃至刑事责任:
● 行政责任:提供虚假的证明、数据、资料、样品或者采取其他手段骗取临床试验许可或药品注册等许可的,将被处以(1)撤销相关许可,10年内不受理其相应申请,并处50-500万元罚款;(2)情节严重的,对相关责任人员,处2-20万元罚款,10年内禁止从事药品相关活动,并可由公安机关处5-15日拘留[25]。
● 刑事责任:故意损毁原始药物非临床研究数据或药物临床试验数据,或编造受试动物信息、受试者信息、主要试验过程记录、研究数据、检测数据等药物非临床研究数据或药物临床试验数据,影响药品的安全性、有效性和质量可控性的,将被认定为妨害药品管理罪,进而可能被处以3年以下有期徒刑或拘役,并处或单处罚金[26]。
临床试验数据真实可靠是基因治疗和基因编辑技术合规监管的重点要求之一,且实践中不乏因临床试验数据造假被予以行政处罚的企业机构。如经国家药监局官网披露,某制药厂有限公司申报的阿司匹林缓释片(受理号:CYHS1190075)等13个药品注册申请存在临床试验数据不真实和不完整的问题,原国家食药监局依规对前述13个药品注册申请不予批准,并对其中药物临床试验机构某大学附属第二医院涉嫌弄虚造假行为予以立案调查,对其所承接的其他药物临床试验数据进行延伸检查,对相关CRO进行延伸检查。[27]由此,为了避免出现基因治疗和基因编辑技术研发面临“从头再来”的风险,相关企业机构需将临床试验数据合规作为研发工作的重要板块之一;在委托CRO开展临床试验的情况下,需加强对CRO的项目监督,切实做好数据稽查等相关工作。
2)跨境合作项目中人类遗传资源跨境传输要求
实践中,开展基因治疗和基因编辑技术研究一定程度上涉及到人类遗传资源的应用或传输,而从事人类遗传资源相关活动主要受到《生物安全法》《人类遗传资源管理条例》及《人类遗传资源管理条例实施细则》等法律法规[28]的规制。人类遗传资源包括人类遗传资源材料和人类遗传资源信息。其中,(1)人类遗传资源材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料;(2)人类遗传资源信息包括利用人类遗传资源材料产生的人类基因、基因组数据等信息资料,不包括临床数据、影像数据、蛋白质数据和代谢数据。[29]
基于我国人类遗传资源跨境传输的现有要求,如基因治疗和基因编辑技术企业机构的跨境合作项目涉及利用我国人类遗传资源的,需要结合不同的利用情形对应遵守相应的监管要求及办理行政许可、备案、事先报告及信息备份等手续:
● 构成外方单位的相关企业不得向境外提供中国人类遗传资源
《生物安全法》规定,境外组织、个人及其设立或实际控制的机构(“外方单位”)不得向境外提供中国人类遗传资源。《人类遗传资源管理条例实施细则》第14条就构成外方单位的情形进行了规定,除了以法律、行政法规、规章规定的其他情形作为兜底规定外,其他三种构成“设立或实际控制”的情形包括:
对于基因治疗和基因编辑技术企业机构而言,则需要判断其是否构成外方单位,如构成外方单位,则不得向境外提供中国人类遗传资源。相关跨境合作项目中涉及我国人类遗传资源的部分活动,则需要采取与我国科研机构、高等学校、医疗机构或者企业(“中方单位”)合作的方式开展。
● 国际合作科学研究行政许可与备案
如相关跨境合作项目涉及国际合作科学研究的,则应按照规定(1)申请国际合作科学研究行政许可,或(2)申请国际合作科学研究备案,但备案仅适用于以上市为目的、不涉及人类遗传资源材料出境的在临床医疗卫生机构开展的国际合作临床试验。需要注意的是,《人类遗传资源管理条例实施细则》明确要求不得将涉及多中心临床研究的国际科学研究合作、国际合作临床试验拆分后申请行政许可或备案。
国际合作科学研究在取得行政许可或备案后的实施过程中,如国际合作协议中已约定由合作双方使用,不需要单独事先报告和提交信息备份,但如果(1)研究已结束或(2)相关跨境合作项目涉及向合作双方以外的外方单位或境外个人提供或开放使用的,则应依法办理科技部事先报告并提交信息备份手续。
● 人类遗传资源材料出境
如相关跨境合作项目涉及需将我国人类遗传资源材料运送、邮寄、携带出境的,则应依法单独提出申请或在开展国际合作科学研究申请中列明出境计划一并提出申请,取得科技部出具的人类遗传资源材料出境证明[30]。
● 提供或开放使用人类遗传资源信息
如相关跨境合作项目仅涉及将我国人类遗传资源信息向外方单位或境外个人提供或开放使用的,则应向科技部事先报告并提交信息备份。其中事先报告的事项包括提供或开放使用我国人类遗传资源信息的目的、用途、相关信息及信息备份情况、信息接收方的基本情况、对我国人类遗传资源保护的潜在风险评估情况等。
此外,如提供的人类遗传资源信息为(i)重要遗传家系的人类遗传资源信息;(ii)特定地区的人类遗传资源信息;(iii)人数大于500例的外显子组测序、基因组测序信息资源;(iv)可能影响我国公众健康、国家安全和社会公共利益的其他情形等的,还应通过科技部组织的安全审查[31]。
若未遵守前述监管要求,依据《人类遗传资源管理条例》第36条、第38条及第39条等相关规定,相关企业/机构将面临被处以责令停止、没收违法所得、罚款等对应行政处罚的风险。
值得关注的是,2023年3月7日,在十四届全国人大一次会议第二次全体会议上公布的国务院机构改革方案,包括重新组建科技部、完善老龄工作体制等内容,其中明确承担“中国人类遗传资源管理办公室”日常工作的中国生物技术发展中心[32]划入国家卫健委。后续人类遗传资源跨境传输监管工作的衔接和安排还需国家卫健委进一步出台相应实施细则明确。
除了上述总结的核心监管要点外,待基因治疗、基因编辑技术产品正式注册上市后,还将面临国家对产品商业化生产和经营的监管。例如,在生产过程中,相关企业机构需要关注对应生产主体是否有药品生产的相应资质、是否满足GMP要求等;在经营过程中,需要关注对应销售主体是否有药品销售的资质、是否满足GSP要求,同时还需关注广告合规、商业贿赂合规等法律合规问题。
基于前述我们对基因治疗、基因编辑技术监管要求的一些总结和思考,我们倾向于建议各相关主体:
第一,了解自身从事的基因治疗、基因编辑技术所属的法律类别及监管范畴,以确定所应适用的法律法规及监管要求,包括外资准入、临床前研究、临床研究、临床试验以及注册等环节监管要求,在公司日常运营和管理过程中内化对应领域法规文件,开展相关合规培训、统一管理制度及建立完善配套规范。此外,还应及时和该领域内监管机关保持良好沟通和交流,关注监管机关职能调整的最新情况等,以更加精准和高效地完成项目申报工作。
第二,明晰自身研究项目开展的阶段和类型,对应了解所在国家(地区)的监管要点,以合规开展有关境内外研究项目/合作,如:(1)应与临床试验机构、CRO、CDMO等合作方在相关协议中明确各方临床研究、临床试验数据相关权利与义务;(2)严格遵守人类遗传资源跨境审批要求等,避免触碰法律红线、减少相关违规风险。
第三,有鉴于各国家(地区)对基因治疗、基因编辑技术领域的关注与重视,可以预见未来相关领域监管文件的出台与更新将愈加频繁,各相关主体应及时跟进国内外及国家地方层面最新立法动态和行业监管执法案例情况,特别需要对技术进出口管制等要求予以跟进,以适时调整公司运营规划和“出海”策略等。
近些年,基因治疗、基因编辑技术已然展现出其独特的临床价值,吸引了一部分优质的国内外相关生物科技企业投身于相关研究,产业发展迅猛、市场规模不断增长。国务院在《“十三五”国家战略性新兴产业发展规划》中也对应提出将推进基因编辑技术研发与应用。建立具有自主知识产权的基因编辑技术体系,开发针对重大遗传性疾病、感染性疾病、恶性肿瘤等的基因治疗新技术。在具有广阔市场发展前景的同时,基因治疗、基因编辑技术的行业监管也将逐步趋向体系化、规范化、严格化。相关主体应严格遵守相关法律法规和时刻注意最新监管动态,合规开展相关研究及合作,优化产品管线和积极推进产品研发进展,争取对应药物早日注册上市,为国内外患者的生命健康带来福祉。
以上就是本文对基因治疗和基因编辑技术行业发展及监管要点的总结与剖析,期待各位行业专家和读者就相关实践和法律问题,随时和我们进行沟通交流。
1.《行业指南:人类体细胞治疗和基因治疗指南》第1.A部分第3段(体细胞治疗和基因治疗定义)。
2.《人的体细胞治疗及基因治疗临床研究质控要点》第I.A部分。
3.杨春艳,王磊,穆登彩,李芳芳,沈昊,郑尚永.基因编辑技术在疾病治疗中的研究进展[J].中国生物工程杂志,2019,39(11):87-95.
4.2023年5月29日。
5.同本文脚注3。
6.同本文脚注3。
7.参见正序生物官网,链接:https://www.correctsequence.com/about2/show.php?id=174#175。
8.参见和元生物技术(上海)股份有限公司招股说明书第208页,图源:弗若斯特沙利文分析。
9.参见动脉网 蛋壳研究院《2022基因治疗行业研究报告》。
10.同本文脚注9。
11.图源及资料来源:弗若斯特沙利文分析,蛋壳研究院。
12.参见医麦客《国外AAV基因疗法完成II期首例给药,国内布局企业及最新进展盘点》,链接:https://mp.weixin.qq.com/s/UOAIoE2LsZVMqUontQ66kQ。
13.同本文脚注9。
14.《民法典》第1009条。
15.《刑法(2020修正)》第336条之一。
16.参见国务院官网,链接:https://www.gov.cn/zhengce/2020-08/29/content_5538302.htm。
内容来源:同写意
责任编辑:胡静 审核人:何发
热点文章
-
2025版药典有哪些内容变动
2024-09-23
-
三种常见制粒技术对中药制剂内在质量的影响及生产过程控制要点
2024-09-27
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
中国药典2025版带来的冲击和影响
2024-10-04
-
洁净工作服清洗、灭菌及使用效期验证
2024-10-14
-
药品检查过程中关于偏差管理的分析与研究
2024-10-15
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
固体制剂高活性车间设计策略
口服固体制剂作为临床应用非常广泛的剂型之一,其传统生产模式存在产尘量大、生产暴露环节众多以及工序复杂等特点。因此,在生产 OEB4-5 级标准的口服固体制剂时,面临的挑战是多方面的。本文从车间建设的角度出发,探讨了针对高毒性或高活性等固体制剂生产所需采取的技术手段与措施。
作者:卞强、陈宁
-
降本增效的能源管理实施建议
-
直播预约 | 小核酸大未来:小核酸商业化生产与厂房设计建设
-
技驭未来,揭秘民营企业科技创新的基因密码
-
小柴胡颗粒连续逆流动态提取工艺研究
-
注射用甲苯磺酸奥马环素无菌检查抗菌活性的去除及验证













评论
加载更多