醋氯芬酸分散片制备工艺技术改进
分散片是指在水中能够迅速崩解,并均匀分散的片剂。分散片具有服用方便、崩解迅速、吸收快、生物利用度高等特点。较普通片剂或胶囊剂而言,分散片可缩短口服给药的达峰时间,并提高峰浓度,具有临床上的治疗优势。而且其便于年老体弱者、吞咽功能障碍者、婴幼儿等特殊患者用药,是很受欢迎的剂型[1-3]。醋氯芬酸常见的剂型为普通片剂和硬胶囊
剂[4],适用于骨关节炎、类风湿性关节炎和强直性脊椎炎引起的疼痛和炎症的治疗。为充分利用分散片的优点,快速减轻患者病痛,增强醋氯芬酸强效解热、镇痛的效果,现将溶解性差的醋氯芬酸制成分散片,对醋氯芬酸分散片的制备工艺进行研究,为醋氯芬酸分散片的生产提供必要的参考依据。
1.实验材料
1.1 设备与仪器
WF-30B万能粉碎机、CH-200槽型混合机、YK160摇摆式颗粒机、FL-200沸腾制粒干燥机、SBH-800三维摆动混合机、ZP37旋转式压片机、JC-TP分析天平、BJ-2崩解测试仪、LC20AT高效液相色谱仪、SDR1911紫外可见分光光度计。
1.2 物料
醋氯芬酸、羧甲基淀粉钠、微晶纤维素、低取代羟丙基纤维素、交联聚维酮、十二烷基硫酸钠、阿司帕坦等物料经检验均符合中国药典2020年版规定的质量标准。
1.3检验试剂
乙醇、0.6%铁氰化钾、0.9%氯化铁、1%盐酸、磷酸、醋酸钠、冰醋酸、双氯芬酸钠、磷酸二氢钾、氢氧化钠、乙腈。
2.制备工艺对比
2.1原制备工艺
醋氯芬酸分散片规格为0.1 g,取原料醋氯芬酸约40%,辅料:羧甲基淀粉钠30%、微晶纤维素15%、低取代羟丙基纤维素10%,按制备工艺:将原料醋氯芬酸粉碎100目,细粉与辅料羧甲基淀粉钠(内加25%)、微晶纤维素、低取代羟丙基纤维素等置混合机混合10 min→加入润湿剂(纯化水适量)→混合3 min→摇摆制粒(16目)→干燥(温度70±5℃、时间约2.5 h)→摇摆整粒(16目)→总混20 min(加入羧甲基淀粉钠5%、硬脂酸镁2%)→压片(冲头Φ9 mm浅凹、转速控制在25-30 r/min),进行压片即得。
2.2新制备工艺
醋氯芬酸分散片规格为0.1 g,取原料醋氯芬酸约40%,辅料:羧甲基淀粉钠20%、微晶纤维素15%、低取代羟丙基纤维素10%、交联聚维酮10%、十二烷基硫酸钠0.2%[5-6],甜味剂和矫味剂阿司帕坦[7],按制备工艺:将原料醋氯芬酸粉碎100目,细粉与辅料羧甲基淀粉钠(内加15%)、微晶纤维素、低取代羟丙基纤维素、交联聚维酮、十二烷基硫酸钠等置混合机混合10 min→加入亲水性粘合剂(3%低取代羟丙基纤维素水溶液适量)→混合3 min→摇摆制粒(16目)→干燥(温度65±5℃、时间约3 h)→摇摆整粒(16目)→总混20 min(加入羧甲基淀粉钠5%、微粉硅胶2%、硬脂酸镁2%)→压片(冲头Φ9 mm浅凹、转速控制在25 r/min),进行压片即得[8—10]。
2.3 颗粒检查对比
按醋氯芬酸分散片原制备工艺和新制备工艺分别进行实验3次,对其颗粒性状、颗粒水分、颗粒含量进行检查。
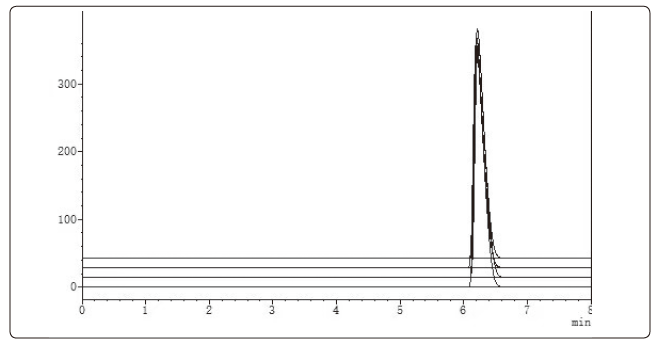
图1 原制备工艺颗粒含量高效液相色谱检查(3次实验叠加图)
(1)合格标准
颗粒性状:应为白色或类白色颗粒。
颗粒水分:≤2.5%。
颗粒含量:本品所含的醋氯芬酸(C16H13Cl2NO4)应为标示量的39.5%~42.5%。
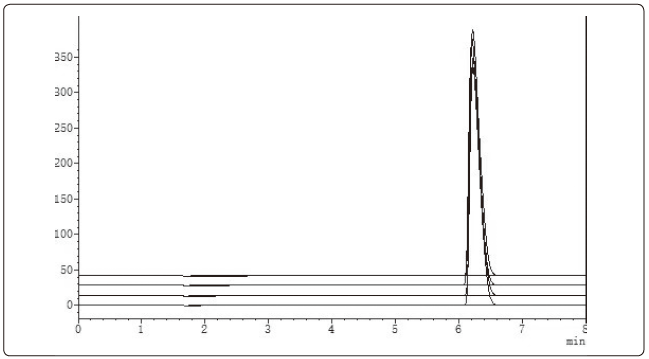
图2 新制备工艺颗粒含量高效液相色谱检查(3次实验叠加图)
(2)检查结果对比
结果对比见表1。颗粒含量高效液相色谱检查对比结果见图1、图2。
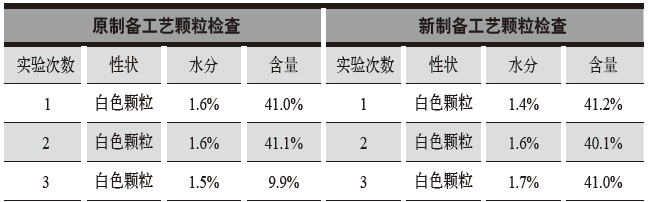
表1 原制备工艺和新制备工艺颗粒性状、颗粒水分、颗粒含量检查结果
(3)颗粒对比结论
经过对比得出:新制备工艺从处方设计上增加了优质崩解剂交联聚维酮、表面活性剂十二烷基硫酸钠,采用亲水性粘合剂替代了原制备工艺润湿剂纯化水制粒,使得制粒更容易、操作更方便,原制备工艺和新制备工艺颗粒的性状、水分、含量等各项检查均符合质量标准要求,检验数据重现性好,检查结果符合规定。
2.4 分散片检查对比
按醋氯芬酸分散片原制备工艺和新制备工艺分别进行实验3次,对分散片的性状、有关物质、溶出度、分散均匀性、含量测定进行检查。
(1)合格标准
性状:应为白色或类白色片。
有关物质:供试品溶液的色谱图中,如有与醋氯芬酸保留时间一致的色谱峰,按外标法以峰面积计算,不得超过醋氯芬酸标示量的0.4%,其他单个杂质(除阿司帕坦辅料峰外)的峰面积不得大于对照溶液中的醋氯芬酸峰面积(0.2%),其他各杂质峰面积的和不得大于对照溶液中醋氯芬酸峰面积的5倍(1.0%)。
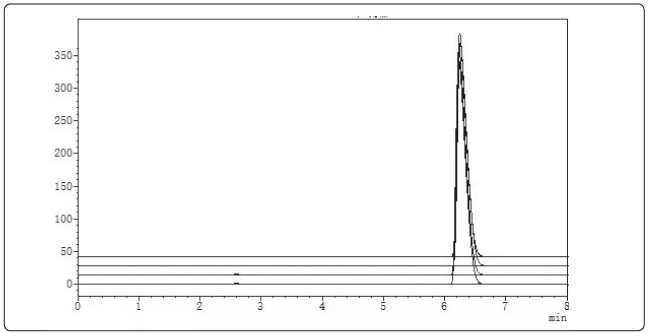
图3 原制备工艺分散片含量测定高效液相色谱检查(3次实验叠加图)
溶出度:限度为不少于标示量的80%。
分散均匀性:3 min内应全部崩解并通过710 µm筛网。
含量测定:本品所含的醋氯芬酸(C16H13Cl2NO4)应为标示量的95.0%~105.0%。
图4 新制备工艺分散片含量测定高效液相色谱检查(3次实验叠加图)
(2)检查结果对比
结果对比见表2。含量测定高效液相色谱检查对比见图3、图4。
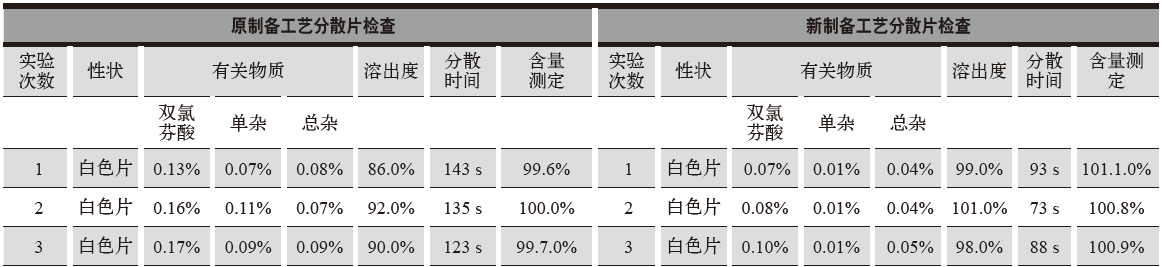
表2 原制备工艺和新制备工艺性状、有关物质、溶出度、分散均匀性、含量检查结果
(3)分散片对比结论
通过对比得出:新制备工艺从处方设计上增加了助流剂微粉硅胶与润滑剂硬脂酸镁,颗粒流动性更好,有利于压片生产。新制备工艺分散片的有关物质醋氯芬酸、单杂、总杂,分散时间均优于原制备工艺。新工艺分散片的性状、有关物质、溶出度、分散均匀性、含量等各项检查均符合质量标准要求,检验数据重现性好,检查结果符合规定。
3.结果与讨论
新制备工艺从处方设计上增加了优质崩解剂交联聚维酮、表面活性剂十二烷基硫酸钠,增加了助流剂微粉硅胶与润滑剂硬脂酸镁,采用亲水性粘合剂3%低取代羟丙基纤维素水溶液替代了原制备工艺中的润湿剂纯化水。新工艺通过以上这些措施加速了片剂的崩解,促进药物的溶出。而且采用新工艺制得的半成品颗粒的性状、水分、含量,分散片有关物质、溶出度、分散均匀性、含量等各项检查均符合质量标准要求。
在实验过程中,发现分散片的制备应根据原料特性(如难溶性药物)考虑是否进行微粉化处理,由于崩解剂处方用量大,生产过程应注意防潮,产品包装应选用合适的防潮包装材料。
【参考文献】
[1]黄大福.分散片研究进展[J].临床医药文献杂志,2017,4(47):9289-9291.
[2]康艳萍.丹参分散片制备工艺研究[J].海峡药学,2018,30(05):8-10.
[3]蓝美英,徐凯,曾华哲,郑晓斌.克拉霉素分散片制备工艺研究[J].中国处方药,2021,19(08):33-35.
[4]国家药典委员会.中华人民共和国药典(2020年版) 二部[M]北京:中国医药科技出版社,2020:1794-1796.
[5]王晓燕,刘韵,潘卫三.国内外交联聚维酮在直压工艺中的一致性研究[J].中南药学,2019,17(04):536-541.
[6]谢英花,张冬梅,韩钰,等.基于增溶作用的阿苯达唑分散片研究[J].河北科技大学学报,2021,42(06):619-626.
[7]国家药典委员会.中华人民共和国药典(2020年版) 二部[M]北京:中国医药科技出版社,2020:676.
[8]门靖,贾玮,王伟,等.药用辅料二氧化硅在医药制剂中的应用研究进展[J].有机硅材料,2018,32(05):416-420.
[9]黄淑萍,何华,吴青青,等.硬脂酸镁对盐酸特拉唑嗪胶囊溶出的影响[J].中国医院药学杂志,2018,38(03):254-257.
[10]张振梁,赵明.扑热息痛分散片的制备工艺及稳定性研究[J].当代化工,2021,50(06):1362-1365.
热点文章
-
科普 | 新药研发全流程梳理(图文版)
2024-12-03
-
重磅!药物共线生产HBEL/PDE评估指南来了
2024-12-17
-
从过程分析技术到药物连续制造
2024-10-30
-
小组件 大作为:细胞和基因疗法 (CGT)工艺的闯关秘籍
2024-12-03
-
一文搞懂《药品生命周期管理》!
2024-12-10
-
中药制剂生产设备智改数转的探索与思考
2024-11-01
-
分享 | mRNA疫苗的研究进展及监管概述
2024-12-11
-
特别专题 | 自动化技术在中药材农药残留检测样品前处理中的应用
样品前处理是中药材农药残留检测的重要环节,是实现农药残留准确检测和中药材质量控制的关键。传统人工检验效率低,将自动化技术应用到农药残留检测样品前处理流程,可显著提升农药残留检测效率。从自动化技术在农药残留检测样品前处理中的应用情况及存在的问题进行论述,提出农药残留检测样品前处理自动化的深化应用思路,以期为提高农药残留检测样品前处理自动化技术水平,促进中药行业实验室检测自动化发展提供参考。
作者:徐影 吕洪亮 陈锐锋 陈忠文
-
特别专题 | 基于化工设备自动化控制的制药工艺优化策略研究
-
特别专题 | 药品生产线档案管理智能化解决方案研究
-
特别专题 | 设备控制系统是药厂实施信息数字化,制造智能化的基础
-
特别专题 | 生命科学行业数字化工厂建设实践分享
-
固体制剂高活性车间设计策略













评论
加载更多