一管血实现癌症检查,靠谱吗?

作者简介
李妙竹,博士就读中科院上海生命科学院,师从遗传学家贺林院士。目前在杜克大学做人类基因组数据分析,系统性探索衰老和长寿的奥秘。
癌症诊断会变得像血糖检验一样容易吗?仅凭一管液体就可能使癌症诊断、疗效评估、实时监控、个体化用药变为可能?
MIT Technology Review 公布的2015年度十大突破技术之一——液体活检(liquid biopsy),以其简单易行、灵敏特异、无创或微创,近来给传统癌症治疗带来颠覆性变革。
对于癌症患者甚至普通的健康人群,这一技术到底意味着什么呢?
首先需要了解液体活检的概念和检测对象。所谓“液体活检”,即从血液、尿液、唾液等体液中捕捉游离的肿瘤核酸、囊泡、肿瘤细胞等,对疾病(如癌症)的标记物进行分子生物学检测。 广义液体活检的对象主要包括三类:游离核酸、囊泡或完整的细胞,如图所示[1]。

液体活检的检测对象
我们接下来将撰文对三类生物标记物一一介绍。本文首先详细介绍明星分子循环肿瘤DNA(circulating tumor DNA, ctDNA)。
ctDNA的发现史
早在1948年,Mandel和Metais就从正常人血液中检测到游离的DNA 片段 (cell-free DNA, cfDNA)。1977年Leon等人发现肿瘤患者体内cfDNA含量明显高于健康个体,而晚期肿瘤患者含量更高。随着研究不断深入,研究者发现在肿瘤患者的血浆和血清cfDNA中,存在与肿瘤基因改变相同的DNA片段,命名为ctDNA(circulating tumor DNA)[2]。
ctDNA的生物学特性
由于巨噬细胞等清道夫的清除作用,通常体液中游离核酸会被实时清除并保持极低含量,每一毫升血浆中,大约只有十几纳克(ng)的cfDNA。比如常规科研实践采集10毫升的血液里,有约2万细胞的cfDNA。但在肿瘤组织中,细胞代谢旺盛导致大量细胞凋亡和坏死,增加释放游离核酸。
癌症患者血液中含有突变片段的ctDNA占cfDNA比例0.01%~90%不等,ctDNA含量与肿瘤类型、肿瘤负荷和肿瘤进展等相关。
一般来说,癌症越晚期的病人,ctDNA的水平越高。片段化、低含量的ctDNA有一些独有特征,如图所示[3]。

ctDNA 的生物学特性
ctDNA的检测技术
常用ctDNA的检测分析方法包括:定量PCR,微滴数字式PCR, BEAMing,标记扩增深度测序方法, 癌症个体化建档深度测序分析方法,全基因组测序,全外显子测序等。[4]
可以对ctDNA进行定性分析,包括检测基因突变、缺失、插入、融合、重排、拷贝数变异、甲基化、微卫星不稳定(MSI)和杂合性缺失(LOH)等;也可以对ctDNA浓度进行定量分析。定性和定量两种方法均可以反映肿瘤的存在和严重程度。
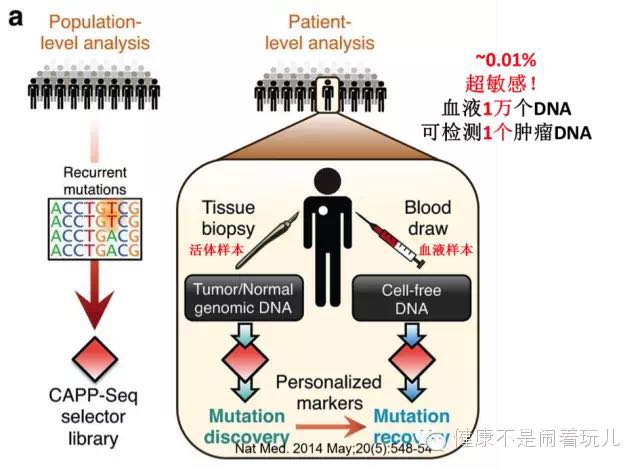
超敏感ctDNA检测技术CAPP-Seq
ctDNA的临床应用
传统癌症治疗中,医生通过手术或穿刺针取出肿瘤样本,在显微镜下观察病理组织切片并进行遗传学分析,做出诊断指导治疗。这种方法具有侵入性和一定风险,而且比较昂贵。对于肿瘤演化产生异质性和抗药性,以及转移期患者体内存在多个肿瘤病灶,单次原位活检存在很大局限。
液体活检ctDNA通过低创无创的方式,让病人摆脱传统组织活检的痛苦,实时多次获取肿瘤基因组信息,大大提高检测的灵敏度和准确性,可能在临床医学有多方面应用。
1.术后判断
通过检测ctDNA水平评估手术效果,判断肿瘤是否已经切除干净。
比如约翰斯霍普金斯医学院的 Velculescu 等研究人员从101例II期胰腺癌患者同时收集肿瘤标本和血液样本,进行全外显子组测序。在接受肿瘤切除的早期胰腺癌患者中,如果检测不到ctDNA说明手术成功预后较好,如果检测到ctDNA,可能有残留组织预后较差,更容易复发,两组病人存在显著差异。同时,与标准CT影像学相比,ctDNA可以提前 6.5个月检测到肿瘤复发[5]。
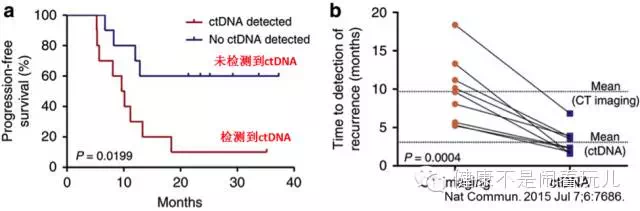
检测ctDNA辅助术后判断
2.动态监测
以 ctDNA作为肿瘤标志物,多次取样定性定量检测肿瘤负荷,监控疾病复发;同时还可以追踪药物响应,通过药物疗效信息及时采取进一步治疗。当靶向药有效时,ctDNA中药物敏感的肿瘤特异突变减少,一旦产生耐药,ctDNA中耐药突变增加。目前在肝癌、乳腺癌、结直肠癌、非小细胞肺癌等多种癌症中都有报道。
最经典的案例之一是来自剑桥大学的研究人员对一名乳腺癌患者长达3年之久的追踪研究。Muhammed Murtaza与同事对一名肿瘤扩散至身体其它部位的乳腺癌患者,分别采集肿瘤样本(活检)和血液样本,他们仔细对比了同一时间点采集的ctDNA和活体组织切片。血液样本中的游离肿瘤DNA与活体肿瘤样本测序结果相匹配,反映了当肿瘤进展和响应药物治疗时的相同模式和遗传变化,说明ctDNA可以时时监控疾病情况,辅助调整治疗方案[6]。
检测ctDNA动态监测肿瘤
3.用药指导
通过对ctDNA中肿瘤特异的突变检测,能够有效反映病人对治疗的响应。取治疗前后的血浆样本,对ctDNA测序鉴定药物治疗过程中产生的耐药突变。
比如斯坦福大学Maximilian Diehn教授及其团队采用新研发的高敏感ctDNA检测方法CAPP-Seq,分别对早、晚期非小细胞癌患者进行检测。1名VI期非小细胞肺癌患者在接受3个月化疗治疗后通过影像学检查发现肿瘤缩小,同时ctDNA水平有所下降。但8个月后,患者ctDNA水平呈现升高,提示隐匿微小肿瘤病灶出现进展。通过对ctDNA检测发现患者存在ALK融合基因,随即使用 ALK融合基因靶向药物克唑替尼进行治疗,患者病情得到很大改善,ctDNA水平也再次降低[4]。
检测ctDNA指导用药方案
4.异质评估
癌症在病人体内不断分裂产生新的基因变异,进化出药物抗性使癌细胞继续存活并增殖。ctDNA可以作为有效标记物,评估肿瘤异质性。
英国癌症研究院的Isaac Garcia-Murillas博士团队,对55位以手术和化疗为根治性治疗的早期乳腺癌患者进行ctDNA追踪,在不同个体中,检测到ctDNA的突变可能只出现在原发瘤或只出现在转移瘤,也可能同时出现两类肿瘤组织[7]。MuhammedMurtaza等用贝叶斯聚类方法PyClone对共发现的 207个功能性突变进行聚类,探索出三组主要肿瘤异种。一组突变主要发生在癌症进化早期,一组突变在所有转移性肿瘤样本中存在高丰度,但在原发肿瘤中不易发现,还有一组突变具有相对多样性,分散在不同时期的肿瘤活检样本中。血液样本中ctDNA含有的随机突变反映了肿瘤单克隆群的不同大小和活性,并揭示出肿瘤异质性变化的顺序[6]。

检测ctDNA进行异质评估
ctDNA的更多进展
除了研究血液中的ctDNA,科学家也在积极探索脑脊液ctDNA作为脑肿瘤液体活检标志物克服血脑屏障影响[8],另有最新报道肺癌患者唾液中ctDNA 呈现与血液ctDNA相近的检测效果[9]。美国公司trovagene坚持多年烧钱探索样源丰富的尿液循环肿瘤DNA标记物等等。
ctDNA检测已获得一些临床和相关机构认可,比如欧盟和中国药品监管局先后于2014年、2015年批准阿斯利康易瑞沙(Iressa)血液ctDNA伴随诊断,用于筛查肿瘤组织不可评估的患者人群。 [10]
不仅临床科研领域ctDNA在癌症筛查和监测等多个层面发展迅速,诸多企业也纷纷涌入开拓市场。连世界著名基因测序仪巨头Illumina也按捺不住,2016年初组建新公司Grail(圣杯)加入液体活检领域,专攻ctDNA在早期肿瘤检测中的应用,吸引盖茨基金、亚马逊创始人杰夫•贝佐斯等多家资金约1亿美元投资(要跟土豪交朋友!)。
介绍了这么多,ctDNA在肿瘤检测、评估、用药中有如此神奇的威力,大家肯定很关心:
健康人群有必要做ctDNA检测吗?
且慢!!
尽管潜力巨大,目前ctDNA还无法成为临床上的主要诊疗手段。
• 早期癌症ctDNA检测难度大。
即使采用超敏感的CAPP-Seq,ctDNA在II-IV期的非小细胞肺癌患者NSCLC中检测敏感性100%,而I期的NSCLC中敏感性仅为50% [4]。与之类似,在近十种640例癌症患者中的研究也报道,47%的I期癌症患者、55%的II期癌症患者、69%的III期癌症患者以及82%的IV 期癌症患者可检测到血液中ctDNA[10] 。也就是说在肿瘤早期筛查方面,仅通过检测ctDNA来诊断癌症的患病风险还有很长的道路要走。
• 不同肿瘤组织中,ctDNA的含量差异很大。
比如在Bettegowda的研究中,只有不到50%的髓母细胞瘤、转移性肾癌、前列腺癌或甲状腺癌,以及不到10%的胶质瘤患者可以检测到ctDNA,而在超过75%的晚期胰腺癌,卵巢癌、结直肠癌、膀胱癌、胃癌、乳腺癌、黑色素瘤、肝癌以及头颈癌可以检测到ctDNA[11]。
不同肿瘤组织ctDNA含量差异大
• 检测结果参差不齐。
ctDNA检测方法需要加强流程规范。包括前期血液处理过程和提取cfDNA方法标准化,提高检测的可重复性。
• 临床实践依然昂贵。
特别是采用更为有效和全面的二代测序技术,目前价格还比较昂贵,有待进一步降低循环肿瘤核酸的检测成本 。
小结
ctDNA检测:
• 临床优势:无创无损,灵敏特异,实时多次,广泛全面
• 临床应用:术后判断,动态监测,用药指导,异质评估
尽管ctDNA检验技术还有待成熟,需要尽快建立统一的临床标准,正如加州大学旧金山分校瘤遗传学项目负责人John Witte所说:“重要的是要保持良好的怀疑态度”。利用精确特异的ctDNA检测,帮助医生像侦探一样敏锐监控癌症进展,跟踪抗性突变,及时指导用药方案。
“将癌症从一种致命疾病转变为一种慢性病还有多远?”
道路是曲折的,前途是光明的,让我们共同拭目以待吧。






加载更多