药品内包材标准ISO 15378对制药公司的启示
随着国内逐步深化改革、推行简政放权——国家药监局对药品内包材(直接接触药品的包装材料和容器,以下简称“药品内包材”)的审批流程也进行了优化与简化。目前国家药监局已不再发放药品内包材的注册证,而代之以与药品注册评审的“关联审评审批”。这一改革给国内的药品内包材企业减轻了行政审批的负担,也使政府对制药行业的监管更加科学、合理。同时也应看到,这一政策对制药企业提出了新的要求和挑战,即药品生产企业要加强对药包材企业的供应商审计,及时掌握药包材的变更情况,对变更情况进行技术评估并上报药监局——需要进行药品补充申请或备案,则视变更的性质而定。
目前国内对药包材企业的现场核查,通常依据《直接接触药品的包装材料和容器管理办法》中的“药包材生产现场考核通则”来实施。目前国内尚未转化任何药包材相关的国际上通行的标准。笔者作为一位在TUV南德(一家德国认证机构,有151年的历史)任职的高级审核员,特撰此文向国内的制药企业介绍一个国际上通行的药包材相关的质量管理体系标准——ISO 15378:2015,希望对制药业同行的供应商审计工作有所启发。同时也欢迎广大药包材企业联系TUV南德,进行ISO 15378的质量体系认证,以提升自身的质量管理水平和信誉度、与国际接轨。
ISO 15378:2015的总体框架
ISO 15378:2015标准是一个基于ISO 9001:2008版框架下的标准。ISO 9001的基本框架,相信大家都不陌生,即P-D-C-A(管理职责-->资源管理-->产品实现-->测量分析改进)。如图1所示。
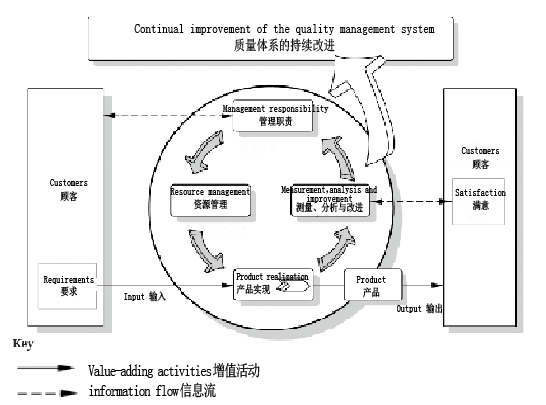
图1 ISO 9001的基本框架
ISO 15378:2015正是在这样的P-D-C-A框架下,在ISO 9001:2008标准的基础上,补充了药品内包材相关的具体要求(即cGMP)。所以应用该标准进行药包材企业供应商审计是非常方便的,熟悉ISO 9001:2008的朋友可以直接跳过标准中方框内的条款(方框内全文引用ISO 9001:2008),直接关注方框外的条款即可。为了方便大家理解,我们可以把ISO 15378概括为如下公式:ISO 15378:2015 = ISO 9001:2008 + cGMP (EU/USA…)。
ISO 15378要点概述
国际知名药包材公司SGD S.A,在其网站上把ISO 15378概括为如下几个要点(风险管理、验证、污染控制、追溯性、变更控制、GMP培训),笔者认为是非常贴切、准确的。
限于篇幅,本文不会把这6大要点(风险管理、验证、污染控制、追溯性、变更控制、GMP培训)全部展开,而是重点向大家介绍3个要点——风险管理、验证、变更控制。
风险管理
举例:ISO 15378:2015, 8.3.1
Nonconforming material or products shall be quarantined pending determination of corrective or other actions. When considering correction via rework or reconditioning, a risk assessment of any adverse effect of the reworking on the products shall be performed and recorded.
如标准要求的,对于不合格产品或物料,如果不直接报废而是进行返工,标准特别强调要进行风险评估,评估返工对产品是否有不良影响。该风险评估要有记录。

除了上面提到的不合格品控制,在ISO 15378:2015的7.1.2小节中,特别强调风险管理过程要贯穿产品实现的全过程,并且要保持相关的记录。而在4.1.1小节里,标准给出了一些明确要求实施风险管理的过程,如:
变更控制
清洁/污染
投诉
设计开发控制
卫生与健康
标签
设备设施维护
物料管理
无合格/质量缺陷(处理)
虫控
采购和供应链
返工
追溯性
验证与确认
令人可喜的是,在具体应用风险管理方面,ISO 15378标准也是与时俱进的。在上一版标准ISO 15378:2011中,该标准还曾列有一个专门的附录,作为风险管理的指南,而没有采用一些国际通行的良好实践。但在ISO 15378:2015中,这个“特立独行”的附录被删去了,而代之以引用国际通行的标准,如ISO 31000、ISO 14971、ICH Q9、GAMP5。这是一个非常大的进步,既提升了标准的先进性,又为广大企业实施风险管理提供了更加标准化、国际化的样板。
验证
在验证方面,ISO 15378:2015给出了一个专门的附录B作为验证指南,其总体流程如图2所示。
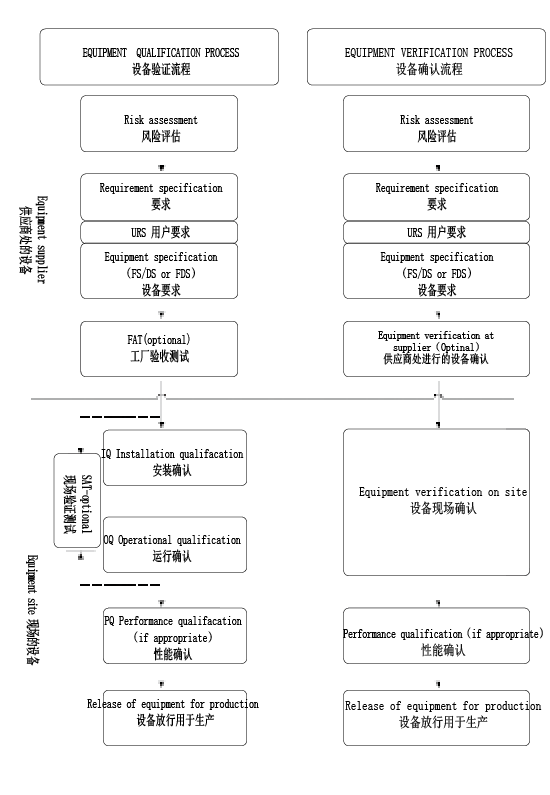
图2 验证总体流程图
相信制药业同行对如上的验证流程应该不会很陌生。而该标准在继承以往良好实践的基础上,又有所创新,提出了一些新的验证理念,笔者认为是非常大胆而精彩的。如表1所示举例(matrix approach)。
表1 矩阵途径的使用举例
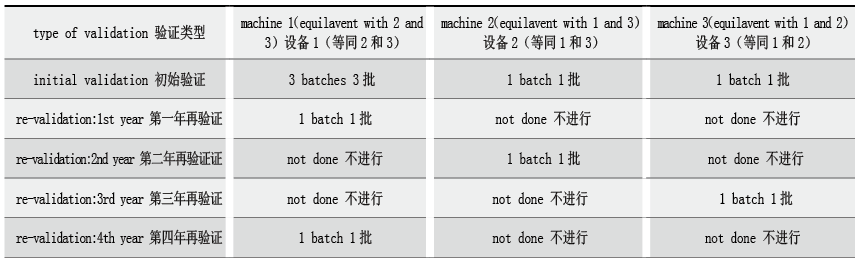
该做法(matrix approach)对于有多台相同设备/相同工艺的企业,无疑是一个福音,可以极大的减少重复性工作。当然这样做也是有前提的,标准中特别强调,对于设备“等同性”(equivalence)的论证,要基于对工艺和产品的充分理解(sufficient process and product knowledge),要有书面的解释说明和技术考虑(technical rationale and justification for decision)。
变更控制
举例:ISO 15378:2015,
7.5.1.3.1 The organization shall establish and operate a documented procedure for an effective changecontrol system, incorporating the evaluation of risk(s) associated with all proposed changes that can havepotential impact on the quality of supplied product.
7.5.1.3.2 The evaluation of the change on the quality of the product shall determine if validation orrevalidation is required.
7.5.1.3.3 The organization’s change control procedure shall ensure supporting data are generatedto demonstrate that the change will result in a product of desired quality and safety, consistent with the approved specifications.
标准强调,企业要有一个正式的变更控制系统,对变更的控制要进行风险评估,要评估是否进行验证或再验证,要有充分的数据来证明变更后产品的质量和安全性仍然受控、仍然符合官方批准的产品标准(approved specifications)。
关于这一段,国内的法规也有类似要求。《总局关于发布药包材药用辅料申报资料要求(试行)的通告(2016年第155号)》中提到:药包材、药用辅料生产企业名称、生产地址、处方工艺、质量标准等发生变更时,其生产企业应开展研究并及时通知相关药品生产企业。药品生产企业应及时掌握药包材、药用辅料变更情况,并按相关技术指导原则进行研究和评估,对影响药品质量的药包材、药用辅料变更应依据《药品注册管理办法》的相关规定申报药品补充申请,对不影响药品质量的药包材、药用辅料变更应依据《药品注册管理办法》附件4补充申请第36项向省级食品药品监管部门备案。
由于药品内包材是直接接触药品的,而且接触的时间往往都比较长(以年计)。所以对于具体的某个变更如何直接影响药品内包材的质量,以及该变更如何间接影响需要长期接触的药品的质量/安全性/有效性/稳定性,确实是一个非常技术性的问题。笔者结合国内的药包材标准,特汇总如表2所示,对各类药品内包材需要考虑的要点进行了总结:
表2 各类药品内包材需要考虑的要点

由表2可以看出,药品内包材种类繁多,涉及不同材料和不同的产品设计。表2内容也仅供参考,在对变更进行评估时,还需要结合具体的产品特性而有针对性的进行评估,不能一概论之、教条主义。
以上就是本人对ISO 15378:2015标准的一些简要介绍,希望能对制药业同行有所启示,欢迎大家的宝贵意见!
ISO 15378要点
Risk analysis and criticity (FMEA)风险分析与严重性
Checking/qualification/validation: 检查/确认/验证
●Manufacturing tools生产工具
●Computerized systems 计算机系统
Contamination risk & cleanliness control 污染风险与清洁控制
Traceability 可追溯性
Change control 变更控制
Operators training in GMP practices对操作工的GMP培训
【参考文献】
[1]《总局关于药包材药用辅料与药品关联审评审批有关事项的公告(2016年第134号)》;
[2]《总局关于发布药包材药用辅料申报资料要求(试行)的通告(2016年第155号)》;
[3]《直接接触药品的包装材料和容器管理办法》(局令第13号);
[4]ISO 15378:2015;
[5]《药品包装材料与药物相容性试验指导原则》;
[6]http://www.sgd-pharma.com。






