在不同的生产方式下生产同种药物活性成分,会产生不同规模和类型的杂质。在某些情况下,这些污染物会使药物丧失其原本的治疗效果,甚至引发致癌风险或对人体造成严重损害。
放眼全球新闻,会不时看到报道这样的案例,制药生产厂搬迁后出现污染,有人因其产生的副作用而患上并发症甚至出现人员死亡的情况。由此可以看出,现有配方的质量控制固然十分重要,但也不能忽略新制剂的开发阶段。这一阶段必须对污染物进行归类和测定,在筛选潜在活性物质时就需要检测其副产物并对目标物质进行分离。
在所有的工作流程中,分析操作占据了很大一部分时间,这是一个不容忽视的因素。如果能够将分析速度加快,便可以检测出更多的潜在活性成分,更快地开发出新制剂以及加快生产过程。下面将介绍一些新的解决方案和方法。

通过HPLC和UV检测污染物
人们通常采用HPLC方法测量杂质和活性物质,但测出的浓度差异很大,如表1所示。欧洲药品管理局的ICH指南为新药的报告、鉴定和定性设立了各种极限值。以摄入量为例,如果每天的摄入量不超过2 g,那么其极限值为0.10%;如果每天的摄入量超过了2 g,则极限值为0.05%[1]。这一测量过程通常需要采用不同的方法分别对污染物和药物进行测定。
借助Shimadzu的新型光电二极管阵列检测器SPD-M40,药物活性成分和杂质的测定变得更加容易。新设计完全消除了杂散光,扩展了线性范围,提高了灵敏度并降低了信噪比。
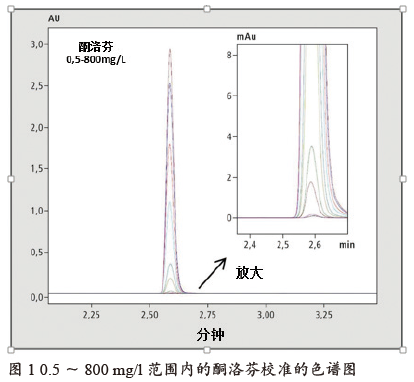
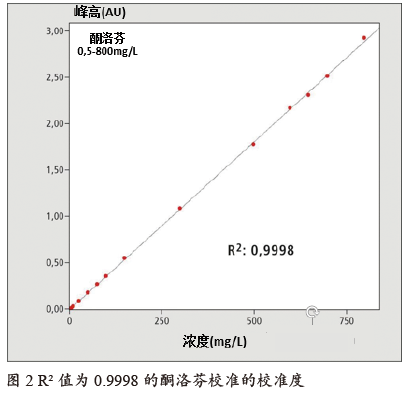
使用酮洛芬制剂检验线性度:制备0.5~800 mg/l的标准溶液并进行测量,分析条件如表2所示。图1是将各种测量值叠加在一起,图2中的面积与浓度对应,形成校准线。尽管校准范围很广,但决定系数R2也达到了0.9998。
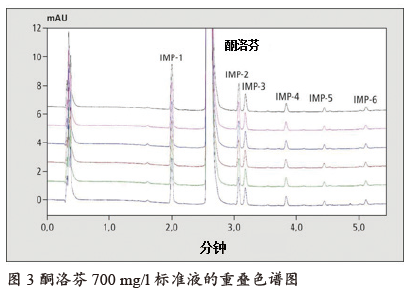
当制备700 mg/l的酮洛芬标准液时,更容易看出其在测定杂质时的优势(如图3所示)。即使污染小于主峰面积的0.1%,也可以轻松鉴别,并且得到的标准偏差依然很小。浓度为0.126%的杂质1是唯一需要鉴别的,其标准偏差为0.598% RSD。
无需第二次测量
由于杂质和主要活性成分可以在色谱图中确定,因此无需进行第二次测量。这样可节省约一半的时间。如果校准浓度范围未达标准,可以使用LabSolutions LC的功能软件i-DReC对其进行扩展。
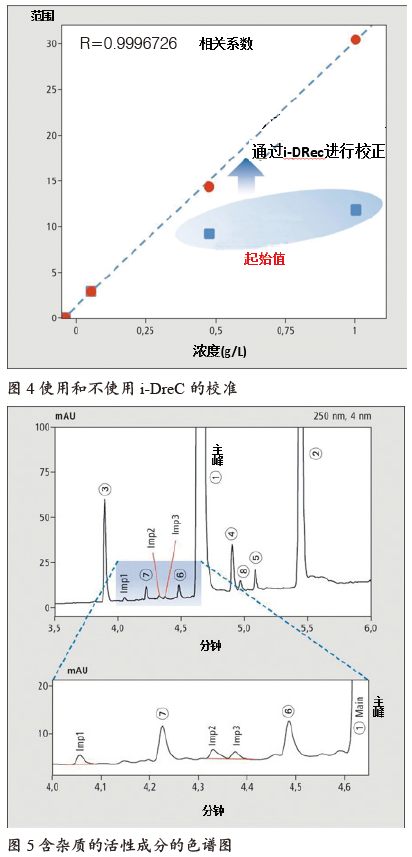
如果光谱中的峰易于辨别,则只有UV光谱的强度会随注入浓度发生变化,而不会随过程发生变化。在正常情况下,为了提高检测限,会对吸光度最高的波长进行检测。如果检测器进入饱和区域,则可以看到校准曲线呈逐渐变平之势。从这点之后,便会脱离图4中通过实例展示的非线性区域(蓝色区域)。
借助i-DReC功能,会自动将目标化合物的第二大UV光谱峰作为目标,其强度较低,检测器不再处于饱和状态,而是处于线性范围内。由于过程没有发生变化,因此两个点的强度之比也便一目了然。该系数可以在两个所用波长之间进行换算,同时校准线可以扩展到更高的浓度范围。
改善后的杂质检出限
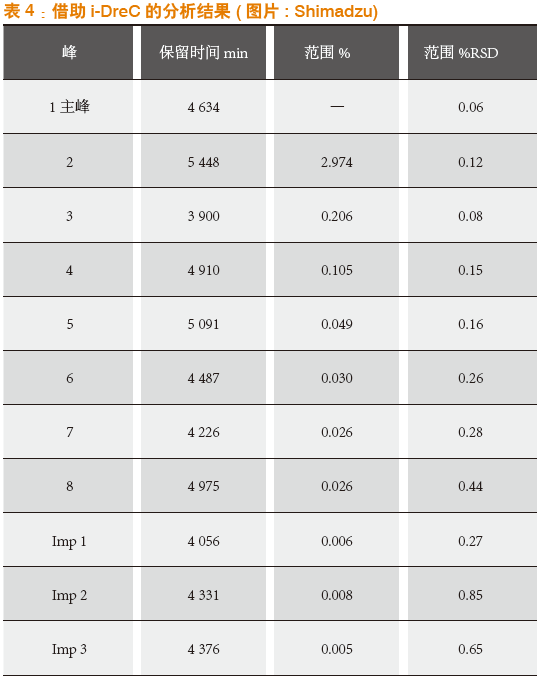
操作结果如图4所示,校准线直到高浓度下都呈线性相关,系数R为0.9996726。如果将其用于典型的活性药物成分(如图5所示),注入浓度还可以高出更多。故可以明显地提高杂质的检测极限。表4总结了这一测量的结果:杂质小于主峰的0.5%时仍能很好地进行测量,相对标准偏差%RSD <0.9。
经常会出现两种物质没有基线分离但却需要定量的情况,如果色谱图非常复杂,换来的可能只是时间的浪费,因为得不到想要的结果。借助功能软件i-PDeA构建的数学模型,可以分离出两种共洗脱物质。但也有一个前提,它们的UV光谱必须不同,为此,人们需要借助单个物质的不同UV光谱。图6通过测量二氟二苯甲酮(DFBP)和乙烯基吡咯烷酮(VP)进行了实例展示,由结果可知,两个独立的检测器通道具有各自分离的峰。也就是说,可以借助功能软件i-PDeA对其进行定量分析。
新的应用领域
这些特性的结合在具有紫外线检测功能的HPLC中开创了新的应用领域,样品的测量次数至此也缩减到了一次。由于SPD-M40检测器与软件功能由经过验证的、满足规范环境(如21 CFR Part 11)和数据完整性要求的软件进行控制,因此这些功能也满足法规的相关要求。
总结
新的技术和功能为优化现有流程和节省资源提供了巨大潜力,凭借其扩展的线性度、很低的信噪比和全新的软件功能(如LabSolution LC的i-DReC),用户仅需一次测量便能确定杂质和活性物质。除了节省时间的优势外,还提供了另一个可能性,即可将污染结果与所测样品进行比对。其他功能(如峰纯度)可用于确定峰的光谱纯度,从而排除所有吸收紫外线杂质的干扰。由于控制软件符合21 CFR Part 11的要求,因此在监管严格的领域中也可使用这些功能。
【参考文献】
[1] European Medicines Agency, ICH Topic Q3A (R2), “Note for Guidance on impurities testing: impurities in new drug substances” Oktober 2006, CPMP/ICH/2737/99
评论
加载更多