CIP清洁性设计的挑战与应对方法
有一个不争的事实:即使是在一些新型生物制品的生产设备中,管道和容器(阀门和其他部件)的清洁过程仍然保留了许多手动或半自动的清洁过程——可能是因为这些过程还未被设计成易于进行CIP清洗的工作流程。由于在这些手动或半自动清洗的过程中,不同程度上还是过多依赖于人的操作,既不可靠,又额外延长了数小时甚至数天的有效生产工期,无形中对产能、生产效率乃至利润率造成了负面影响。
以韩国的一家大型生物制品公司为例。这家CDMO公司目前已经安装了96 000 gal(1 gal=3.785 l)的生物反应器,并计划在未来两年内再安装68 000 gal的生物反应器。该公司在更换产品时,会对上一生产批次中使用过的所有密封件和隔膜进行更换,并手动清洁所有阀门和其他部件,每次的更换时间大约为一周。换言之,如果需要经常更换产品,则会损失20%以上的有效产能。虽然在调试期间,其他设备已设法验证了CIP清洗工艺(通常是匆忙完成的,并没有有效地对其改进,依然存有众多会导致 “可清洁性”问题的设计缺陷),但如果系统、容器(罐、反应器、发酵罐)、阀门和其他部件的设计不符合“CIP友好”的要求,就只能额外补充2~3个满足TACT要素的条件,才能完成清洁验证。
TACT即:
Time(时间);
Action(作用),包括工艺管线中CIP流体的湍流,沿容器壁向下流动等参数;
Chemistry(化学或浓度);
Temperature(温度)。
清洁设计亟待规划
如果没有对CIP可清洁性进行事先设计,仅凭TACT方法不足以产生真正强大的清洁过程。众所周知,补充改进参数与重新验证的过程费时耗力,即便完成了此过程的清洁验证,避开极为漫长的清洗周期(单次运行数天)不谈,大量使用高温和腐蚀性化学添加剂也会对整个系统的密封件和阀隔膜造成严重破坏。虽然过程中水、能耗以及化学品的额外成本巨幅增加,但与失去的产能相比,这一成本便显得微不足道。密封件和隔膜的损坏不仅会导致潜在的污染或交叉污染的风险(如图1所示),还会增加预防性维护成本。

清洁设计的6大挑战与应对方法
从相关领域权威人士基于科学和风险方法而写的多篇文章中可以得知:可靠的流程可以显著降低风险,提高产品质量,减少验证压力并简化验证过程。
以下6大痛点,是目前阻碍行业实现快速、可靠的CIP工艺过程的关键问题。
清洁死角
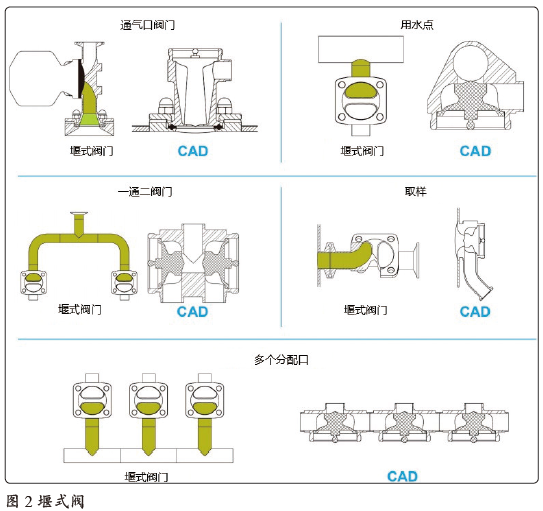
ASME BPE(2019)标准要求L/d<2,实现这一要求的前提条件为,在垂直管路上使用堰式阀(如图2所示)。阀座和水平主管路之间有一段盲端,长度为L(堰式阀不建议使用“T”型);如果使用的是柱塞式阀门,就可以使隔膜与容器内壁齐平,并与管道内壁齐平,使L=0。因此使用了柱塞式阀门后(即实现L/d=0)可确保垂直方向上的支路更易于清洗,避免流量较低的区域形成生物膜等。
与O型圈、堰型阀隔膜、爆破片等相关的渐近区
CIP清洗时产生的湍流无法到达与O型圈、堰型阀隔膜、爆破片等相关渐近区,并且它们从不排水。由于毛细管的作用,会导致它们之间、它们与金属间的夹层充满液体,直到系统加热时液体才会被蒸发——留下典型的残留物“环”(如图3所示),在手动清洁或维护过程中会发现它们的存在。

部件排水不良
由于设计原因,许多阀门不易排水。这些阀门往往被建议安装在一定的角度上,以“改善”排水能力。如果不更换排水设计更好的阀门,运营者应遵循这个建议。传统的组合阀或块阀(通常为堰式阀)有着更为复杂的排水情况,应避免使用。而柱塞式阀门则与之不同,它们有着更为简洁的排水管路,可轻松实现排水。
线路排水不良
线路排水不良时,可对管路施加适当的倾斜角度。ASME BPE(2019)标准中有可用于重力排水的工艺管线。
过大的总管道体积
使用3D和P&ID设计软件可对具有多种不同端口选项的阀门进行无死区设计,通过对特定功能区进行封闭焊接,可使其成为优秀的排水方案。经设计的阀门,其水平管道滞留体积可减少30%~40%。
罐底阀的最大设计流量小于最大CIP流量
如果遇到罐底阀的最大设计流量小于最大CIP流量的情况,通常有3种选择:一是选择具有更高Cv的阀门;二是在CIP过程中对容器加压;三是在CIP过程中对阀门出口施加真空。其中,第三种方式特别适用于已使用真空进行过完整性测试的容器或加速SIP过程(真空/蒸汽脉冲在加热阶段吹扫空气和SIP冷凝液,冷却阶段冷却/干燥)。
另特附Shirokizawa矩阵供参考[1](如图4所示),纵轴表示清洗过程的能力或可靠性(数字越小代表的能力越强),横轴表示毒性或风险水平。

小结
制药行业,尤其是生物制药行业,正以惊人的速度发展。行业的关注点往往是在生产过程(如灌注)上,而一些NNVA(必要的非增值)过程(如清洗或消毒),在过去的三四十年里似乎并没有取得进步。但是,优化这些NNVA流程却可以显著提高企业的利润和产能——特别是对于那些勇于接受变革的公司而言。
【参考文献】
[1] Andrew Walsh, Osamu Shirokizawa.The Shirokizawa Matrix: Determining The Level Of Effort, Formality, & Documentation In Cleaning Validation. Bioprocess Online, 2019.






加载更多