工艺过程中的取样原则与策略(一)
ICH Q10 制药质量体系中对工艺性能和产品质量的持续改进进行了说明,同时对四个制药质量体系要素之一——工艺性能和产品质量监控体系(PP&PQMS)的关注内容进行了说明。
ISPE的PQLI(产品生命周期实践)指南-4工艺性能和产品质量监控系统(PP&PQMS)第二章变异性和取样,在ICH Q10的基础上切实的讨论了在制药工艺中变异性的起源并介绍了变异性的测量和数据分配的内容,该章中同样讨论了取样内容,来帮助理解制药工艺中变异性的起源和变异性的测量和取样。
分析与说明
1、取样原则
变异的来源
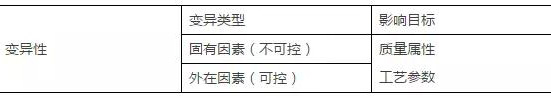
风险评估可以应用识别变异性的影响性。风险管理活动可以实施在整个产品生命周期内,来保证管理持续识别的风险,以下图为例:
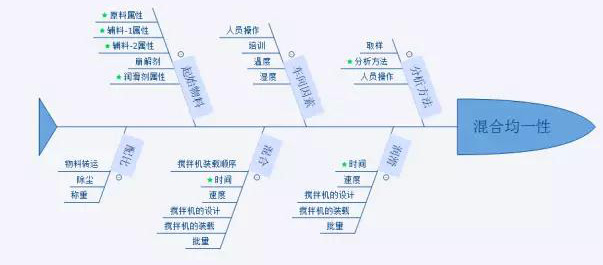
图中标绿色星号的内容为高风险的变异会影响该工序的关键质量属性,变异对应的为输入物料的关键质量属性和关键工艺参数。
以上分析结果为:

取样的原则即为:

下面为以设备PQ取样策略为例进行说明:
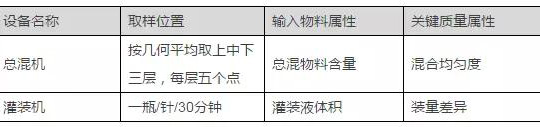
2、取样数量
2.1 每一批次的样品量是很容易管理的,通常是采取代表性样品,而不是进行100%的检查。这就意味着批次中的取样是一个较小的数量值并且更多的信息会“丢失”,可以获得一个可控的样本大小作为交换。
2.2 如果一个样品是较小的数量值,每批的平均值和标准偏差将会被评价。然而,一些样品的平均值和标准偏差将会获得并用来评价,这样就会增加一些信心,防止平均值和标准偏差的统计不相同。大的样品量将会更多的给一个准确的值分布图。
2.3 取样计划
明确的确定取样计划的目标
取样计划确定相关的要求,例子可能包括:
随机的
分层的
混合的
系统的, e.g., 单元操作的开始,中间和结束
目标(e.g., 最差条件)
取样的理由和测量的误差
取样量,统计能力和分析精密度之间关系的确定
工艺变异的类型和渴望检测到的变异量
总结
以上为针对ISPE的PQLI-4中在取样数量的概括性介绍进行了取样原则和策略方面的分析,为有效的应用工艺性能和产品质量监控体系提供支持。
本文来源:奥星合规性咨询
免责声明:编辑上述内容,对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。仅作参考,并请各位自行承担全部责任。







加载更多