CDE年报解读:临床批件易得 生产批文难求
国内药品注册审批速度正明显加快。
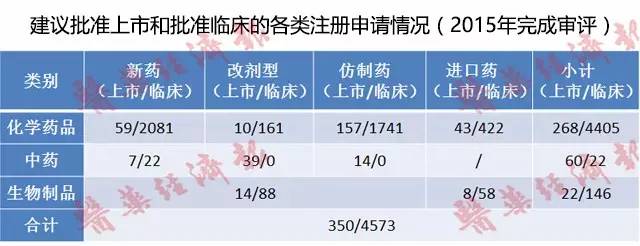
根据3月3日CDE公布的数据,2015年CDE已完成审评建议批准上市和批准临床之比为1:13.07。也就是说,13.07个获批临床数才有可能对应1个生产批件。化学药品新药批准上市和批准临床之比为1:35,化学药仿制药批准上市和批准临床之比为1:11.09。
以上数据存在时间差,批准上市药品对应的是过去批准临床的数量。但此数据可从侧面上反映CDE对临床和生产批件审评审批的态度正向欧美特点“接轨”,即:临床易进,生产难出。
IND的批准率为86%,NDA的批准率为28%。以这个数据为参照,如果不考虑企业中途自主放弃,则1类新药受理号的上市几率可能为24%。3.1类仿制药对应验证性临床批准率为75%,上市几率可能为21%。6类仿制的上市几率为62%。
根据咸达数据V3.2,2015年1月至2016年2月共14个月,已有5034个化学药品受理号获得临床批件。然而,生产批文数却有越来越少的趋势。2015年度CFDA共批准化学药品上市注册申请241个;2016年1月份,CFDA共批准国产化学药品上市申请2件(个位数)。
1.1类新药:抗肿瘤药立项意愿强烈
无论从注册法规还是临床应用限制看,各项政策法规的指向是,药品审批对于药品是否安全无效越趋严谨。
越来越多企业开始思考布局化药1.1类新药,其中不乏原来主营业务是中成药的企业。如广东众生药业股份有限公司发布公告声明,正与上海药明康德新药开发有限公司合作开发治疗肝癌的一类新药ZSYM006。根据公告,双方的合作金额为3200万元人民币(不包括临床研究费用),其中众生承担 2400万元。此前众生已与药明康德于2015年8月、9月及2016年1月分别签订了“治疗耐药性肺癌的一类新药ZSYM003的研发”、“治疗肿瘤的一类新药ZSYM004的研发”及“治疗甲型流感和人禽流感的ZSYM005的研发”的《技术开发(合作)合同》。项目的签订过程可见广东众生的转型决心。
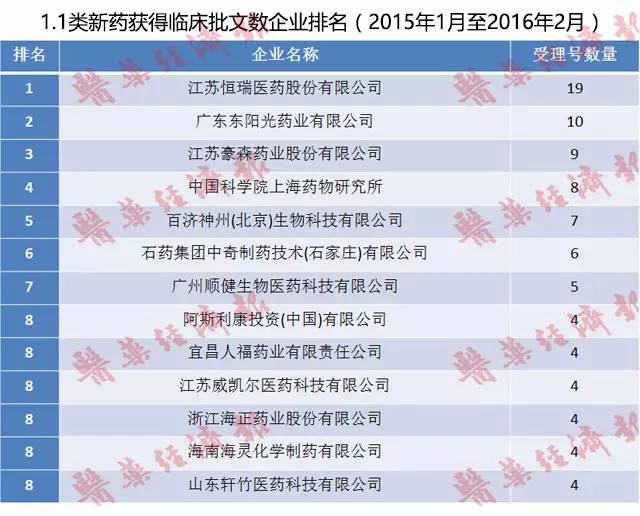
近14个月,化学药品1.1类新药获得临床批文数203个,分别由67个企业所获得。临床批文TOP 3企业分别为江苏恒瑞、广东东阳光和江苏豪森。
1、江苏恒瑞
排名第一的是江苏恒瑞医药股份有限公司,共有19个受理号获得临床批件。根据咸达数据V3.2江苏恒瑞获批临床的产品主要有SHR0302(原料药+片剂)、SHR7390(原料+ 片剂)、SHR3680(原料+片剂)、SHR4640(原料+片剂)、SHR6390(原料+片剂)、M6G(原料+注射液)。
其中,类风湿性关节炎用药SHR0302(原料药+片剂),晚期去势抵抗性前列腺癌用药SHR3680(原料+片剂),高尿酸血症、痛风用药SHR4640(原料+片剂),黑色素瘤和实体瘤用药SHR6390(原料+片剂)尚未招募受试者。用于术后镇痛治疗用药M6G(原料+注射液)已有第一例的受试者,试验还在进行中。仅SHR7390(原料+片剂)在2016年2月获批临床尚未开始准备临场试验,初步推断SHR7390仍是抗肿瘤药。综上所述,江苏恒瑞的产品申报依然以抗肿瘤药为主,止痛、类风湿关节炎用药为辅。
近三年来(2012~2015年),江苏恒瑞已储备化药1.1类新药临床批件47个,是当之无愧的中国制药工业中坚持新药创新典范。
2、广东东阳光
排名第二的是广东东阳光药业有限公司,其发力方向主要是肿瘤药中的酪氨酸激酶抑制剂,获得的临床批件有:甲磺酸莱洛替尼(原料+胶囊)、盐酸博昔替尼(原料+胶囊)和马来酸英利替尼(原料+胶囊)。
甲磺酸莱洛替尼主要治疗晚期实体瘤,目前正准备开展Ⅰ期临床试验。盐酸博昔替尼和马来酸英利替尼尚未开始准备临场试验。
3、江苏豪森
江苏豪森药业股份有限公司以9个受理号数排在第三。近14个月获批临床的产品有HS-10234(原料+片剂)、HS-10220(原料+胶囊)和HS-10241片。
HS-10234主要用于抗HBV,HS-10220主要用于消化性溃疡,HS-10241片为抗肿瘤药中的c-Met抑制剂。
点评
近14个月1.1类获批临床受理号数排名较多的前三企业,每一家企业都有抗肿瘤药的1.1新药临床批件。抗肿瘤药除了获得重大专项用药、优先审评审批缩短了注册时间的支持外,近年来由于患病人数增加,临床市场一直保持15%以上的高增长,更加大了厂家对此类药物立项的决心。
3.1类和6类:扎堆获批,临床不能说做就做
近14个月,共有2003个3.1类受理号获批临床,其中7个制剂产品在这期间获得的受理号数20个以上。6类受理号获批临床共1750个,其中14个制剂产品近14个月获得的受理号数20个以上。
曾经堵塞的临床申报审评审批通道突然集中审评然后“放水”了,国家局的审评审批重心不再是“卡”临床前的申报资料,而是考核药品的生产质量和临床有效性是否值得上市。那么,大“放水”之后临床试验的进展如何?
1、阿齐沙坦片
以近14个月获批临床批件最多的3.1类产品阿齐沙坦片为例。目前在开展评价阿齐沙坦片治疗高血压有效性和安全性的临床试验和健康受试者人体药代动力学试验的厂家有2家。
恒瑞在2014年10月获批,2014年11月就获得伦理通过,然而第一组入组却要等到2015年3月底。可能受最近临床自查核查影响,基地开展临床试验招募受试者难度增加,2016年3月,恒瑞在吉林大学第一医院又发起了阿齐沙坦片人体药代动力学研究。
同在2014年获批的还有南京华威。根据南京华威子公司江苏礼华官方网站2015年6月的报道,此项目南京华威很有可能已经技术转让给香港李氏大药房。根据CDE公布的数据,目前该临床试验仍处于尚未招募受试者阶段。
阿齐沙坦片近14个月获批的78个受理号都是在2015年11月才开始获得临床批件,目前暂无一家开展临床。
2、罗氟司特片
罗氟司特片近14个月获得51个受理号数排名第二。
合肥立方制药股份有限公司在2013年5月获得罗氟司特片的临床批件,合肥立方制药和南京华威共同合作的临床试验2015年3月才获得伦理通过,现已招募完成。
石家庄智恒医药在2014年10月获批临床,他与江苏柯菲平医药有限公司共同合作的临床试验于2014年12月获批伦理,2015年1月第一例受试者入组,2015年6月30日试验完成。
江苏恒瑞在2015年5月获临床批文,2015年9月获批伦理,第一个受试者入组在10月,目前仍在招募受试者。
在江苏恒瑞之前,有好几家企业获批临床,如天津市汉康、山西仟源和重庆华邦等,但都没有开展临床试验;而在恒瑞之后7~8月间,也有好几家企业获批临床,如北京阳光诺和、江苏正大天晴和北京北京赛科等,也没有开展临床试验。
3、盐酸鲁拉西酮片
盐酸鲁拉西酮片以31个受理号数排名第三。2013年,住友发起临床试验并已完成,2015年提出生产申报。
江苏豪森在2015年3月获批临床,5月获得伦理同意,10月第一例受试者入组。临床批件集中获批的月份是8月起,但暂无一家企业正式开展临床。
点评
以上数据表明,如果顺利的话,临床试验第一例受试者入组可以在拿到临床批件后半年内完成。即使产品获批临床批文数较多,也不是所有企业愿意继续投入做临床的,这个可能与产品有关。比如申报3.3类临床的布洛芬注射液,愿意启动临床的企业已经接近10家,包括成都天台山、重庆市庆余堂、南京先声东元和四川阳光润禾等。四川阳光润禾是最早获批临床的,该项目已转让给成都苑东药业有限公司,成都苑东在2013年已经开始申报生产,4个受理号全折在本次自查核查撤回中。
此外,吉林大学第一医院可谓2016年临床基地的“劳模”,目前已经参加7个不同药物的临床试验,包括其中4个项目的伦理委员会。中国医学科学院肿瘤医院参加了4个肿瘤药物的临床试验,负责其中3个项目的伦理委员会,排名第二。
总结>>>
“产品为王”时代:向左?向右?向前冲?
3类和6类临床批件数量突增,必然会导致临床批件的价格短期下降。由于目前临床试验成本增加,最终能够上临床的项目是有限的。在优胜劣汰的压力下,能够生存下来的将是项目质量较高的项目供应方。长期而言,项目价格将会回归理性。
CFDA审评审批的重心,向药品生产质量和临床有效性的考核转移,新上市药品的生产批文数量将与美国、欧盟看齐,这意味着流通市场上的新产品数量有限,“产品为王”的时代来临。
对于生产企业来说,必须充分考虑产品的投入和回报:有的企业会选择做研发创新,将更多资源投入1.1类新药;有的企业会更注重仿制,资源投入于提升质量,逐步走向国际化;有的企业可能就直接转走保健品,对于研发的投入相对成本没有药品那么高。而选择的方向将影响企业的渠道选择、利润等。






加载更多