如何优化生物制药上游生产的工艺效率
生物制品的生产状况
多年来,许多公司生产的生物制品中大部分产品是多肽、蛋白、单克隆抗体和抗体片段。生物制品生产大多采用不锈钢生物反应器和分批补料工艺,以及使用常规的QC 和QA 体系来放行成品批次。生产设施往往规模庞大,投资额高,投资成本也主要集中于固定成本以及上游和下游的独立工艺。
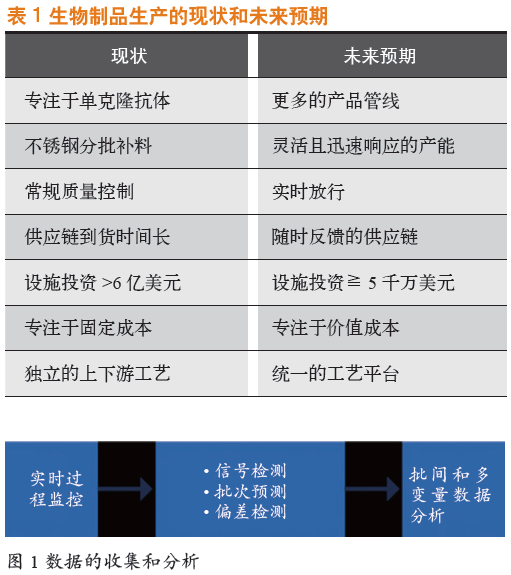
随着行业需求的变化,生物制品生产也随行业的变化而发展,详见表1。药物开发商希望朝着更大的生产灵活性和更快的市场响应能力方面发展,其部分原因是由于市场对复杂生物分子药物(如双抗、ADCs、溶瘤病毒、CAR-T 技术和基于RNA 干扰药物)的需求不断增长。此外还有其他因素,例如,药物临床试验阶段,公司需要在不同的研发阶段使用不同数量的产品;药物批准并进入市场时,需要尽快建立供应链等,这些均促使厂家提高灵活性和对市场的快速响应能力。
药物上市后,需求的不确定性依然存在。不确定性的驱动因素包括临床结果、根据推荐值和临床实际情况变化的剂量水平、患者人数变化(随着新适应症获得批准,患者人数会发生变化),以及取决于药品价格和竞争情况的市场接受度。此外,还需要缓冲成本压力。这可能是由药物排他性、高昂的开发成本或医疗体系预算所致。
建立全球影响力可以帮助厂家灵活应对突然变化的市场需求,以及满足需求不断增长国家(如印度、中国等国家)的市场需求。例如,使用封闭式一次性系统以较低的先期投资创建较小的设施,也可以在多个不同的地点,以较少的固定成本建厂。
因此,生物制品生产的目标是建设灵活、高效且性价比高的生产项目,同时可以在一个工厂或不同工厂轻松扩产或复制,从而在本地或全球增加产能。构建这个平台需要从细胞系开发开始, 然后逐步简化流程。细胞系开发是所有生物制品生产的基础。
加速细胞系开发
传统的细胞系开发涉及细胞转染,分选和基于扩增能力和生长性能的克隆评估。从开始到结束,整个开发过程大约需要40 周。此外,还有许多增强细胞系开发的潜在方式。
传统的筛选过程是将单个细胞放入96 孔板孔井中,筛选50 ~ 100 块板, 并选出最高产量的细胞。相比于单独筛选,操作员将非常少量的细胞混合成池,选择性能最好的细胞池。然后对这个较小的细胞池进行筛选,最终筛到单个细胞。目前市面上有不同的设备可供选择。例如,荧光激活细胞分选(FACS)结合谷氨酰胺合成酶(GS)选择系统使用,可进一步加快工艺速度。微流体在克隆评估中,可以在5 天内得到增殖速率和细胞特异性扩增的结果。转染是流程化开发细胞系的起点,它使得靶点整合不再依赖随机事件,而是允许开发人员在细胞中将基因插入预定插入点。这种特异性增加了高产细胞系的产生,并减少下一步所需的筛选量。当这些步骤组合在一起时,可以明显将细胞开发时间缩短至8 ~ 10 周,并可以显著缩短目标生物制剂的毒性研究时间。
加快工艺开发
优化流程的下一阶段是工艺开发阶段。首先使用高通量系统(如平板、冻存管和微生物反应器),然后进入平行实验室规模的生物反应器,从250 mL 到5 L 或10 L 规模的生物反应器。平行实验室必须能够反映和预测出中控和生产规模的条件和性能,以便使放大生产的过程尽可能顺利。
过程分析至关重要,并应该实现自动化且整合到上游工艺和仪器中。这些分析将提供大量非常重要的数据,诸如从原料(如细胞培养基和层析填料)获得的数据,从生物反应器和捕获步骤中获得的数据以及从药物产品中获得的数据。然而,挑战在于信息的获取和存储,以及之后的评估。数据只有通过分析且具有相关性才有价值。数据收集和分析,即将所有数据输入数据库到数据分析的过程,如图1 所示。
为了从数据及其分析中获取更多信息,分析过程不仅需要查看输出,还需要关注不同子系统之间的交互。例如,实时监控可用于预测如何开发一批产品并进行偏差检测。通过批次之间的比较,工艺开发人员可以更好地了解如何改进工艺和减少误差。
将分析过程越紧密集成到工艺中,分析效果越好。理想情况下,上下游的实时分析意味着可以从开始到结束“动态”地修正工艺流程,从而提高产品质量和产量。数据来源于整个工艺流程的信息,比如进入生物反应器的原料、层析数据,以及纯化和过滤步骤的详细信息。
工艺强化
许多生物制药公司通过种子生物反应器阶段(N-1 级)来寻求工艺强化的优势。另外还有两种方法也可以提高批量生产力。第一种是使用高密度、大容量的细胞库,只需一步即可放大生产。该细胞库用于接种到1 ~ 10 L的摇摆式灌流生物反应器。当细胞扩增到足够的体积和密度后,接种到最大2 000 L 的生物反应器中。该过程仅需2 周或更少的时间,可以将上游生产前的准备时间缩短一半。第二种是在灌流过程中进行N-1 级扩增,以培养足够的细胞,以更高的细胞密度为生产生物反应器接种。这样,可以将生产生物反应器中的培养时间缩短约5 天。
利用系统生物学进行工艺设计
受基因组、蛋白质组和代谢组的影响,细胞的生物学特性会对工艺结果产生影响。通过对路径建模并将建模知识输入工艺开发中,可以使用系统生物学改进宿主细胞系, 还可以改进工艺设计和培养基开发。比如,对系统进行更改,然后分析细胞的mRNA,可以显示与细胞周期代谢相关的细胞途径上调和下调的变化。此信息可用于修正培养基,提高特定细胞产率。
通过实时分析实现在线发布
如前文未来预期生产状态所述,QC 和QA 检查及放行的步骤非常繁琐,会明显延长生产时间。因此,需要一款获取多个质量属性且可以在线分析的方法。这种快速捕获方法还可以将有关质量属性的信息反馈给流程。
整合和自动化
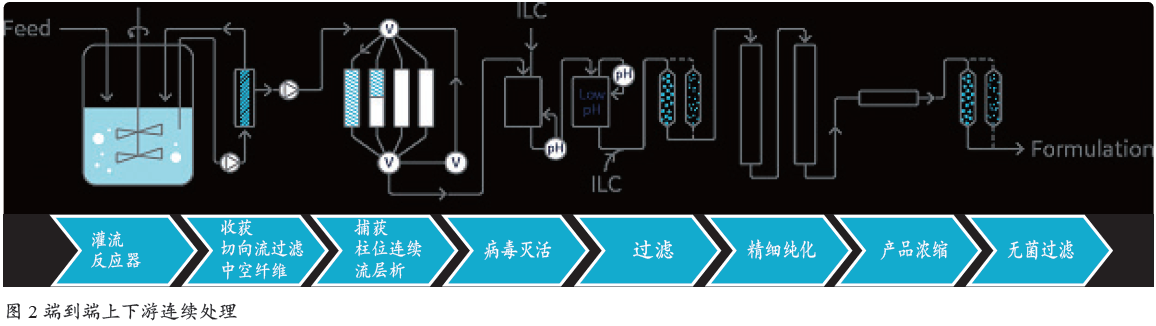
整合分析和优化流程为自动化系统的潜在发展打开了大门。自动化系统可以检测和处理过程中的偏差,并在无需人工干预的情况下进行修正。这种自动化的下一步发展可能是连接上游和下游,创建整合的连续生物生产平台(图2)。但是,完全整合的系统需要高水平的精度、控制力和执行力,以及可靠的试验方案来解决问题。
最终目标
细胞系开发、工艺开发和工艺强化、实时分析、过程整合和自动化都是生物制药生产厂家用于优化工艺效率的重要方法。此外,管线研发中如何更好地降低成本、更灵活且更快速地响应生产,都是满足生物制品行业不断变化需求必需考量的。然而,最大的影响可能来自于工艺改进方面,即如何整合上游和下游工艺,并朝着更加自动化的方向发展。终极目标是从细胞和培养基开始到成品完成的整个过程均能实现完全集成和自动化。






加载更多