单克隆抗体下游工艺病毒清除能力的研究
来源于细胞系的生物技术产品可能存在被病毒污染的风险——其程度取决于多种因素,包括制备的来源、使用的原材料、生产系统、纯化试剂和赋形剂等。研究生产过程对病毒的去除或灭活作用,是降低病原性病毒医源性传播的潜力,进而降低风险的关键步骤,这对于产品的安全性至关重要。在生物制品进入临床试验和上市之前,必须证明其生产过程具有清除已知和假定病毒的能力。本文将从单克隆抗体(mono-clonal antibody,简称mAb)下游纯化工艺病毒清除能力研究的方案、影响因素和创新及挑战等方面进行论述。
文/ 王湛清
本文由白帆生物科技(上海)有限公司供稿。
1 单抗产品病毒安全性评估
关于病毒清除能力的研究,通常是通过将已知滴度的指示病毒加入到不同生产工艺阶段的中间品中,再测定经特定工艺处理后的样品中残留病毒的滴度,最后通过计算出病毒滴度对数下降值(log reduction value,简称LRV)进行评价。对于LRV≥4log10的工艺步骤一般可认为是有效的病毒清除步骤。LRV<4log10的工艺可认为有助于提高生产过程总病毒清除率。但是由于病毒验证的局限性,LRV≤1log10的工艺对于病毒清除的意义不大,其LRV值不计入生产过程的总量中[1]。
采用模拟生产工艺(缩小的工艺)的方法时,应尽量设计与实际生产工艺相关及合理的病毒去除/灭活研究试验方案,尤其是有效的生产工艺步骤,模拟的工艺在试验参数及控制条件方面应与实际工艺严格地保持一致。
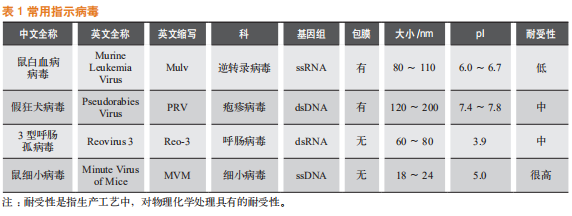
2 常用指示病毒和验证方案
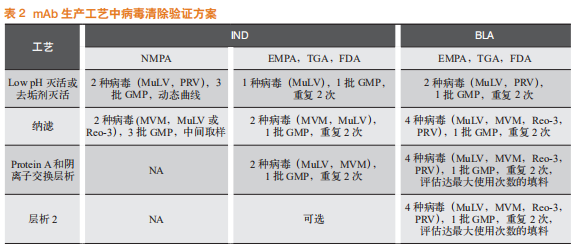
常用的指示病毒见表1。在新药研究申请(investigational new drug,简称IND)阶段,生物技术产品需要对至少2种模型病毒进行病毒清除研究,通常选择一种逆转录病毒(X-MuLV)和一种细小病毒(MMV)。在生物制品许可申请(biologics license application,简称BLA)阶段,通常使用3~5种特异性/非特异性病毒进行病毒清除研究,并评估3~5个工艺步骤,以从病毒安全性的角度证明产品具有足够的安全系数。由于国内外指导原则不同,用于申报的病毒清除验证步骤存在一些差异。mAb生产工艺中常用的病毒清除验证方案见表2。
3 下游工艺的病毒清除能力
3.1 下游工艺对不同病毒的清除能力
截至2009年,向FDA提交的IND和BLA的单克隆抗体产品中[2],Protein A亲和层析、Low pH、阴离子交换层析AEX(流穿模式)、阳离子交换层析CEX(结合-洗脱模式)和除病毒过滤的病毒清除验证最常用的指示病毒科及对其清除作用的平均值和范围如图1所示。
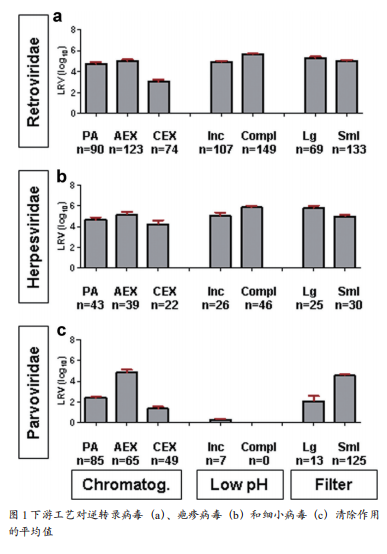
对于逆转录病毒,除CEX的LRV约3log10外(如图1中a柱形图所示),其他工艺均能够稳健地清除(LRV≥4log10)。疱疹病毒与逆转录病毒的清除效果相似且LRV>4log10(如图1中b柱形图所示)。小型无包膜病毒(如细小病毒)则较难有效地清除,它们对化学处理具有耐受性,且不易被过滤器截留(如图1中c柱形图所示)。只有AEX和小型病毒过滤器能够有效地清除细小病毒科(平均LRV>4log10)。
图1中所示工艺依次为Protein A、AEX(流穿模式)、CEX(结合-洗脱模式)、Low pH灭活(“不完全”与“完全”清除)以及大孔径与小孔径的除病毒过滤。
3.2下游工艺对病毒清除能力的影响因素
各工艺的LRV值的分布情况如图2所示。将0~2log10的研究归为低LRV组,将大于6log10的研究归为高LRV组进行对比
分析。
3.2.1 Protein A亲和层析
Protein A工艺的LRV值与平衡/洗涤缓冲液、填料、洗脱液组成及洗脱pH值均无明显相关性。低LRV组的共同点是原料相当复杂,可能是原料与填料复杂的相互作用对层析柱去除病毒的能力产生了负面影响。
3.2.2 AEX(流穿模式)
Strauss等人的研究表明AEX(流穿模式)上样的pH值和电导率可以影响LRV[3]。而Miesegaes等人的统计结果显示,与Protein A类似,AEX(流穿模式)的LRV与不同缓冲液、填料、pH和电导率等变量无明显相关性,可能原因是申报的案例工艺条件中优化了pH和电导率。
3.2.3 CEX(结合-洗脱模式)
CEX工艺的病毒清除作用不够稳健。高LRV组的LRV与缓冲液、经验水平或任何层析柱性质(如柱高和树脂类型)无明显相关性。然而,高LRV研究中使用的平衡/上样及洗脱pH值均较低,为5.3±0.2;而低LRV组中pH为6.0±0.2。另一个因素是缓冲液中盐浓度也会引起LRV值差异。低LRV研究使用的缓冲液中盐浓度较高,上样/平衡液中NaCl的平均浓度为290±120 mM,洗脱液中NaCl的浓度为340±70 mM,而高LRV的研究中NaCl的浓度分别为58±27 mM和183±31 mM。
3.2.4 Low pH灭活
Low pH工艺中,pH值是一个关键过程参数,pH为3.8时足以灭活逆转录病毒[4]。其中,低LRV研究组的pH值为3.9,而高LRV研究中pH值为3.4。
3.2.5 除病毒过滤
不论是小孔径还是大孔径的滤器,清除MuLV的LRV值均不低于2log10,只有1%的研究低于3log10(图2中h柱形图和i柱形图所示)。大孔径病毒过滤器对逆转录病毒的总体清除率低于小孔径病毒过滤器(如图1中c柱形图所示)。影响细小病毒清除结果的主要原因是过滤器类型不同。总的来说,除病毒过过滤能够可靠地清除病毒。
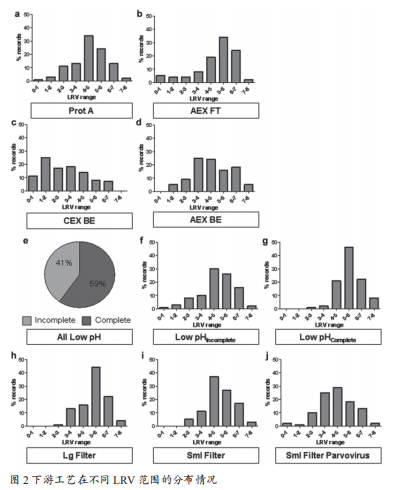
图中工艺依次为Protein A(a)、AEX流穿模式(b)、CEX结合-洗脱模式(c)、AEX结合/洗脱模式(d)、Low pH灭活(“不完全”与“完全”清除)(e~g),以及大孔径(h)与小孔径(i~j)的除病毒过滤(其中,a~i:逆转录病毒;j:细小病毒)。
4 病毒安全性评估的创新与挑战
生物制药下游工艺领域在不断地发展与创新,势必会带来病毒清除评估的创新[5]。以上游和下游工艺领域的进展——以连续流生物工艺为例,评估和建立有效且稳健的病毒清除过程十分必要。在连续流过程中,诸如病毒灭活和病毒过滤等步骤预计仍将以批处理方式进行。虽然在连续流模式下,色谱过程的病毒清除能力不应与分批处理过程有本质区别,但必须有数据进行支持。
5 展望
从病毒学安全性的角度来看,生物制药行业具有出色的安全性,很大程度上可以归功于行业严格遵守病毒安全的3个关键策略:充分寻找材料和细胞库来源并检测,记录病毒清除评估(病毒验证研究)和进行过程中病毒测试。新型细胞底物生产的生物药物特性可能会发生变化并伴有不同的风险,确保生物药物的安全性需要良好的风险管理策略。
白帆生物拥有经验丰富的专业技术团队,覆盖从研发、小试、中试到规模化生产的完整产业链,建立了针对各类肿瘤和自身免疫性疾病的单克隆抗体药物产业化基地,拥有独特的NONCROS?多产品共线生产技术、智能信息化管理系统、高表达量的宿主细胞平台等,可有效缩短新药上市时间,提高有效产能,降低药物成本。
【参考文献】
[1] ICH Q5A(R1).Viral safety evaluation of biotechnology products derived from cell lines of human or animal origin. 1998.
[2] Miesegaes G, Lute S, Brorson K. Analysis of viral clearance unit operations for monoclonal antibodies. Biotechnology and Bioengineering, 2010, 106(2):238-246.
[3] Strauss, D. M., Lute, S., Tebaykina, Z. et al.Understanding the mechanism of virus removal by Q sepharose fast flow chromatography during the purification of CHO-Cell derived biotherapeutics. Biotechnology and Bioengineering, 2010,104(2):371-380.
[4] Brorson K, Krejci S, Lee K. et al. Bracketed generic inactivation of rodent retroviruses by low pH treatment for monoclonal antibodies and recombinant proteins. Biotechnology and Bioengineering, 2008, 32(3):321-329.
[5] Shukla A A, Aranha H. Viral clearance for biopharmaceutical downstream processes. Pharmaceutical Bioprocessing. 2015, 3(2):127-138.






加载更多